背景
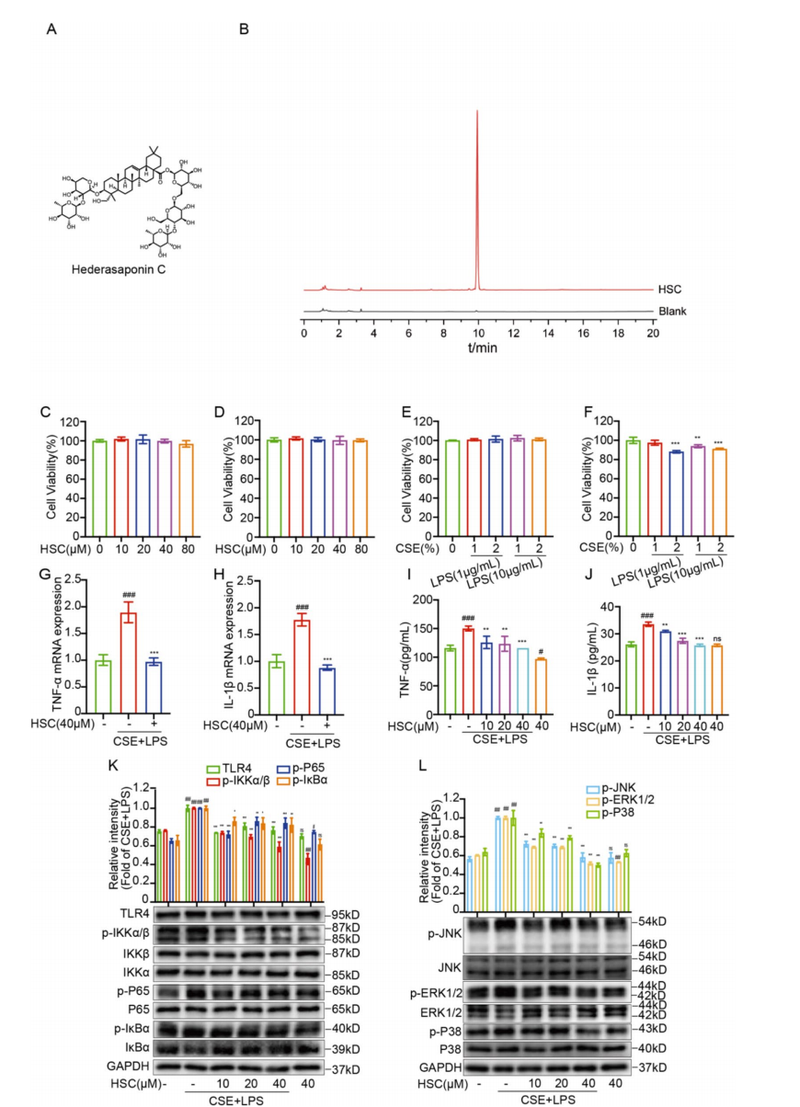
慢性阻塞性肺疾病(COPD)是一种多因素导致的复杂慢性呼吸系统疾病,主要由长期暴露于有害气体或颗粒物(尤以吸烟为主)引发,其病理特征包括气道和肺泡结构的异常改变,慢性气道炎症反应,黏液过度分泌,以及肺组织的重塑与破坏。其中,核心机制涉及免疫炎症信号的持续激活,尤其是细胞表面模式识别受体TLR4介导的下游NF-κB及MAPK信号通路的活化,诱导大量促炎细胞因子的释放和细胞外基质金属蛋白酶(如MMP9、MMP12)的上调,促进气道组织破坏和气道壁的重塑。

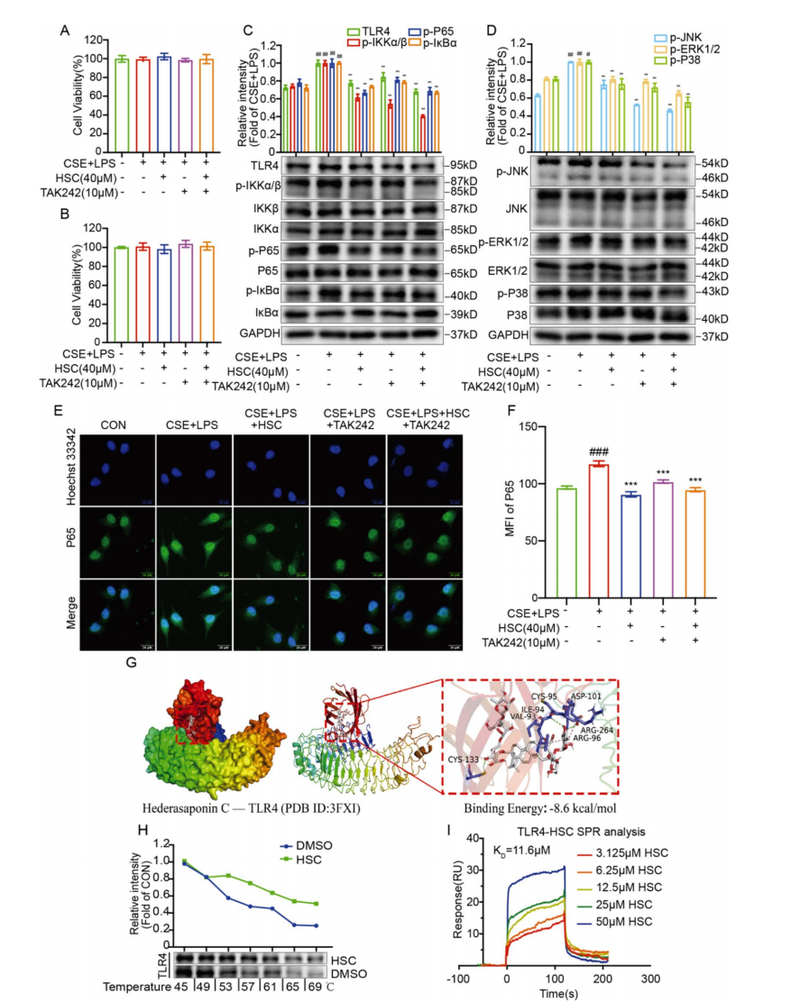
HSC在不损害A549细胞活力的浓度范围内,明显抑制CSE+LPS诱导的TLR4、磷酸化p65、IKKα/β、IκBα以及MAPK家族成员JNK、ERK1/2和p38的过度激活。 RT-qPCR及ELISA显示,HSC显著降低关键促炎因子TNF-α及IL-1β的mRNA和蛋白表达。 与TLR4特异性抑制剂TAK-242联用,HSC对信号通路抑制作用更显著,分子模拟与生物物理实验证明HSC能稳定结合TLR4,阻断其功能。
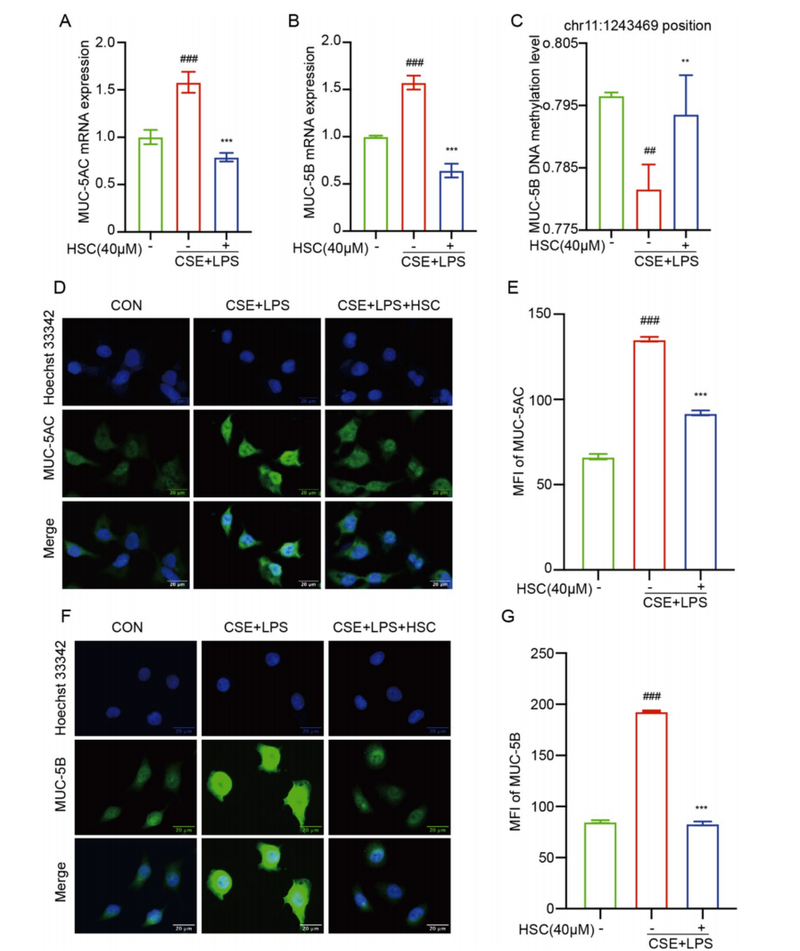
HSC显著降低CSE+LPS诱导的MUC-5AC和MUC-5B mRNA及蛋白水平。 通过靶向亚硫酸盐测序发现,MUC-5B启动子区域chr11:1243469位点DNA甲基化水平在COPD模型中被降低,而HSC能显著恢复该甲基化水平,提示其通过逆转基因低甲基化状态,抑制了MUC-5B的异常高表达。
HSC治疗组COPD模型小鼠体重显著改善,血液中淋巴细胞计数增加,NLR、PLR及新型指标RCI均明显下降(表征系统性炎症缓解)。 BALF和肺组织中TNF-α、IL-1β含量减少,肺组织H&E染色显示炎症细胞浸润及肺泡结构破坏获得显著缓解。 多重免疫荧光分析显示HSC降低肺组织中TLR4、MMP9、MMP12、MUC-5AC及MUC-5B蛋白表达。 主要器官H&E染色未见明显毒性表现,显示安全性良好。
本研究证实,HSC通过直接靶向TLR4受体,阻断其激活下游的NF-κB及MAPK信号通路,显著抑制了COPD模型中炎症因子的产生,恢复了蛋白酶与抗蛋白酶的平衡,减少了气道主要粘蛋白过度分泌。这一多靶点作用机制赋予HSC抗炎与减轻气道重塑的双重优势。 特别值得强调的是HSC对MUC-5B启动子甲基化状态的调节,显示出其能通过表观遗传机制控制粘蛋白基因表达,弥补了现有治疗手段在黏液分泌异常上的不足。 此外,HSC来源天然,其安全性较高,并且相关药代动力学研究表明HSC吸收迅速、剂量响应明显,具备潜在的临床转化价值。与糖皮质激素相比,HSC展现了更显著的抗炎效果,且未表现出免疫抑制相关副作用,尤其在针对吸烟引起的COPD模型中表现优异。 未来工作中,应进一步完善对HSC抗氧化应激路径的探索,深入评估其对肺功能的改善作用,以及系统评估MMP酶活性和组织抑制剂的变化,以建立更全面的机制图谱。同时,临床前的药代动力学-药效动力学结合研究和安全性评价不可缺少,为未来临床试验奠定坚实基础。