近日,甘李药业在第84届美国糖尿病大会上公布了其自研创新GLP-1受体激动剂GZR18的重磅数据:经35周治疗,GZR18一周一次给药组体重较安慰剂的平均百分比下降18.6%,两周一次给药组体重较安慰剂的平均百分比下降13.5%。
该数据与主要竞争对手相比,一周一次给药35周减重超过司美格鲁肽68周数据(较安慰剂减重14.4%),且优于替尔泊肽36周同期安慰剂调整后数据(约16%);尤其还开发了两周一次给药,35周减重数据与司美格鲁肽同期数据相当!另外,从甘李药业官方解读来看,GZR18大概率能够在正在进行的II期临床试验中获得更惊喜的数据。根据公开披露信息,GZR18是一款单靶点GLP-1 RA,在资本和Biotech都在疯狂追逐MNC“蓄意”引领的多靶点浪潮的今天,让我们首先明确想要实现Next-WIN(winner in next generation),GLP-1 RA开发的目标是什么。而后,我们将分析GZR18的开发策略如何使其具备成为一款Next-WIN GLP-1 RA的潜力。
GLP-1 RA的开发目标
(一)优效:达到20%~30%的减重效果
早在2018年,诺和诺德便提出了药物达到20~30%的减重目标。这个目标的意义在于向上可替代或衔接减重手术,向下可兼容医美需求。美国减重手术市场规模在10亿美元左右,而一台减重手术的费用平均约1万美元,费用高昂,使得实际接受减重手术的人数仅约10万人/年,而肥胖患者群体(BMI>33且适用减重手术的群体)超过7000万人,意味着大多数人因为高昂的费用、对手术的恐惧以及缺少具备绝对疗效的药物而选择保守治疗,这部分群体代表着超500亿美元的市场潜力,甚至还没有包括超重群体与非超重的医美群体,这表明减重目标的提高能够带来巨大的市场空间。目前,全球范围内已批准减重适应症上市的GLP-1 RA药物中,仅有替尔泊肽证明可以在72周的治疗周期内达到20%以上的治疗效果。而从GZR18此次披露的数据看,不仅在中国竞争环境中独出其右,与头部企业诺和诺德和礼来的产品比起来也不遑多让,预计也具备着突破20%,达到25%或以上的潜力(表1)。
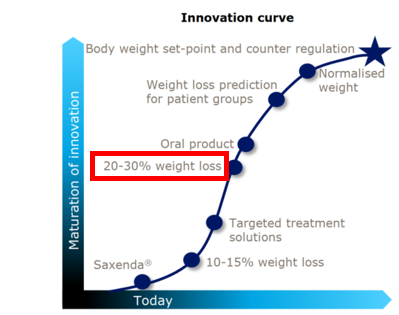
图1 诺和诺德减重领域布局
表1[1][2][3][4]
靶点
| 试验周数
| 减重百分比(安慰剂调整)
| |
GZR18
| GLP
| 35
| 18.6%
|
Semaglutide-诺和
| GLP
| 68
| 14.4%
|
Tirzepatide-礼来
| GLP/GIP
| 72
| 20.1%
|
CagriSema-诺和
| GLP/Amylin
| 32
| 15.6%(非安慰剂调整)
|
Retatrutide-礼来
| GLP/GIP/GCG
| 48
| 22.1%
|
Mazdutide-信达
| GLP/GCG
| 32
| 13.1%
|
HRS9531-恒瑞
| GLP/GIP
| 24
| 16.7%
|
PB-718-派格
| GLP/GCG
| 12
| 4~6%
|
(二)多效:多重获益
减重适应症的GLP-1 RA存在报销限制,由于价格高昂,很难覆盖大面积的患者人群。在监管部门对超适应症用药的管控越来越严格的当下,仅有减重效果的GLP-1 RA很难走远。GLP-1首先是一个降糖靶点,保证降糖效果的前提实现减重目标才是GLP-1 RA的正确开发策略。2023年4月,Wegovy因确证心血管获益进入美国Medicare D医保目录,更进一步说明了实现降糖、减重及包括心血管、肝肾保护在内的多重获益是GLP-1 RA的重要开发目标。
(三)长效:更长的给药周期
纵观GLP-1 RA的开发历史,从短效日制剂到长效周制剂,其降糖效果的差异充分证明了长效即优效(图2)。同理,减重领域也是类似的,核心逻辑就是对于慢性疾病而言,追求的是长期的持续获益,因而更好的患者用药依从性就能带来疗效指标的长期获益。
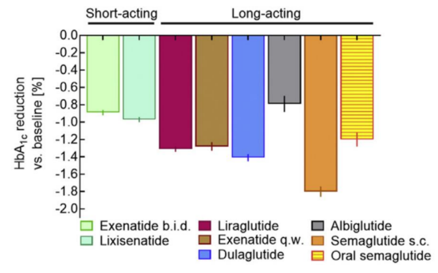
图2 GLP-1 RA降糖效果对比[5]
从患者的角度讲,由于需要长期甚至终身治疗,日制剂一年需注射365次,而周制剂只需52次,密集的给药频率极易导致漏打现象的发生,从而带来疗效不足的问题;从医生的角度讲,长效制剂注射次数更少,血药浓度相对更稳定,大大降低了患者的血糖变异性,从而降低了慢病患者的诊疗和管理难度,也更容易获得患者的认可;从降糖和减重药物的市场表现来看,长效制剂显然更受医生处方青睐,市场份额远超短效制剂(图3)。
因而,更长的给药周期也是GLP-1 RA开发的另一个目标。
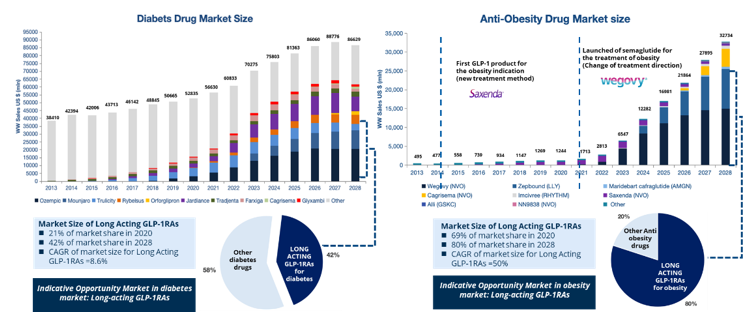
图3 降糖、减重药物市场规模
GZR18的开发策略
全球范围内,目前仅甘李药业GZR18作为一款单靶点产品有望突破20%大关,实现20%~30%的减重目标,说明除了增加靶点以外,GZR18的单靶点开发策略也能实现GLP-1 RA的开发目标。以下我们对GZR18的开发策略做一个详细分析:
(一)活性降低、延长起效时间
首先,若对GLP-1 RA的药效进行分析,可以发现临床药效与能实现的最大剂量成正比(图4)。
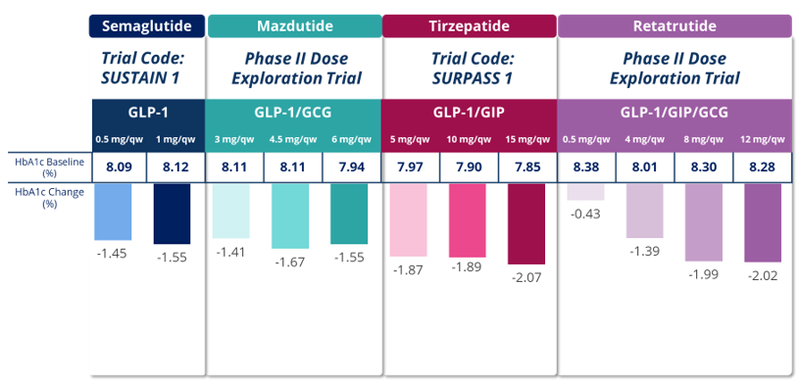
图4 GLP-1 RA药效与剂量的关系[1][2][4][6]
一般来讲药物剂量由其药理活性决定,药物分子的活性一般使用EC50表征,EC50越大,分子活性越低,所需药物剂量也越大。在合理范围内,降低药物活性可以使量效曲线变缓,进而使得起效剂量和毒性剂量之间的距离变大(也即是安全窗变大),这样利于使用时进行剂量调整(图5)。对于GLP-1 RA来说,目前最常使用的治疗方式是诺和诺德首创的滴定治疗,即小剂量起始建立耐受,而后逐渐增加剂量,达到更高的,疗效更佳的可耐受剂量。司美格鲁肽的剂量可达2.4 mg,但本身的安全窗仅在1 mg左右,就是滴定治疗的功劳。
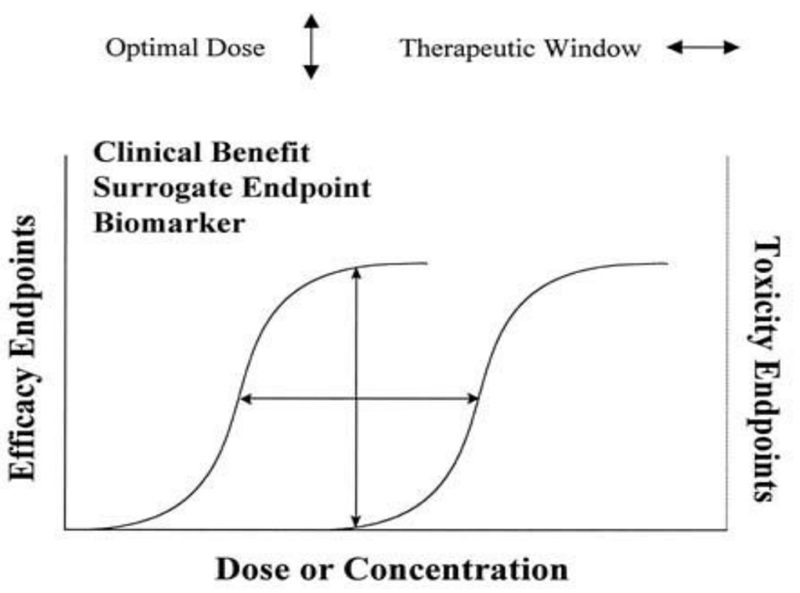
图5 起效剂量、毒性剂量与安全窗[7]
从这个思路出发,我们对比了司美格鲁肽、替尔泊肽与GZR18的非临床数据(表2)及临床数据(表3)。可以推测,GIP靶点的引入使得替尔泊肽较司美格鲁肽降低了分子活性,匹配滴定治疗(从2.5 mg历经5个剂量爬坡到最高目标治疗剂量15 mg)的方式,帮助患者更好地建立耐受,达到了司美格鲁肽6倍以上的剂量,实现了更佳的治疗效果。
表2 非临床数据对比[1][2][8]
临床最大剂量
| EC50 (nM)
| Tmax (h)
| |
司美格鲁肽
| 2.4 mg
| ~0.21
| ~14
|
替尔泊肽
| 15 mg
| ~0.62
| 未找到
|
GZR18
| 30 mg
| ~1.91
| ~12
|
表3 临床数据对比(均为安慰剂调整数据)[1][2]
临床最大剂量
| 试验周数
| 终点减重数据
| 35周同期数据
| |
司美格鲁肽
| 2.4 mg
| 68
| 14.4%
| ~11%
|
替尔泊肽
| 15 mg
| 72
| 20.1%
| ~16%
|
GZR18
| 30 mg
| 35
| 18.6%
| 18.6%
|
因此,GLP-1 RA药效的关键在于适中的活性。相比起来,甘李药业开发者进一步降低了GZR18的分子活性,同时,为了减少药物的副作用,帮助患者建立耐受,还延长了GZR18的起效时间(Tmax),让患者的副作用更为平稳缓和(替尔泊肽的Tmax数据未找到,但人体数据中司美格鲁肽与替尔泊肽的Tmax相当,均在30小时左右,可以预测GZR18在人体中的Tmax应长于司美格鲁肽与替尔泊肽),最终使得GZR18减重效果远高于司美格鲁肽,至少和替尔泊肽相当。GZR18作为一个单靶点激动剂,能够毫不逊色于多靶点激动剂,这与甘李践行的开发策略密不可分。
不得不说,敢于在资本疯狂追求多靶点的时代,依然冷静头脑,独辟蹊径,充分体现了甘李药业在内分泌慢病领域的多年积累以及对慢病治疗药物的深刻理解。
(二)开发单靶点,优化分子结构,降低开发风险
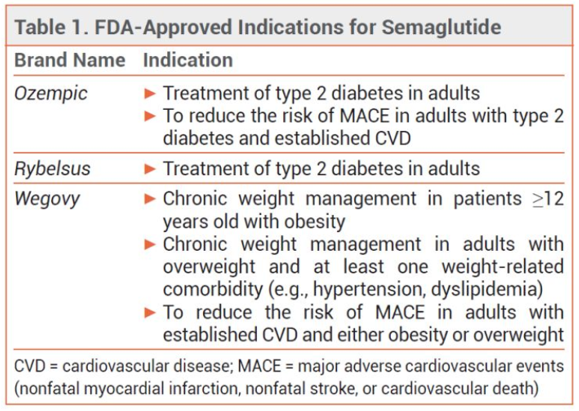
图6 司美格鲁肽适应症
GLP-1单靶点的最大优势在于均衡,GLP-1靶点之外的未知风险小,开发风险极低,因为GLP-1 RA已在临床使用超过15年,其安全性已得到充分验证。目前,司美格鲁肽已经把能做到的适应症都摆在桌面上(图5)。结合GZR18的开发策略,我们可以预见GZR18的降糖数据会如同减重数据一样有望超过司美格鲁肽,且在心血管、肝脏等各项指标中亦能观察显著获益。特别的是,GZR18分子结构上不含非天然氨基酸,和人体GLP-1结构同源性94%以上,减少了由于氨基酸突变可能带来的潜在安全风险。最后,单靶点药物在与其它药物联用上风险可能更低,基于GZR18分子,无论是与甘李药业周制剂胰岛素GZR4,还是和Amylin进行复方制剂的开发,未来空间都值得想象。
(三)合理的减重速度才是最快的减重速度
最后一个点是减重速度,也是被大家通常忽视的一点。现在各企业都在追求“短平快”,即想在更短的时间内减掉更多的体重,这是为了获得早期关注所采取的一种策略,通常在临床中采用大剂量起始,缩短爬坡期的办法实现,但这可能是错误的且有很大风险的,可能给人体带来较大副作用(如胆结石和电解质失衡等)[9],且长期给药后药效(6个月以上)不佳等问题。因此我们在分析数据时,一定要结合AE报告和治疗周期来看。
例如,礼来三靶点Retatrutide中,尽管4-8 mg剂量组(4 mg起始)在16周之前减重更快,但48周的药效就被2-4-8-12 mg剂量组(2 mg起始)反超(安慰剂调整)。同时,从安全性上看,4-8 mg剂量组的胃肠道副作用发生率也远高于2-4-8-12 mg剂量组。可以推测4 mg起始的患者将难以达到12 mg,从而长期药效将逐渐落后于2 mg起始,但能达到12 mg的患者。
表3 Retatrutide不同剂量组对比[4]
24周减重
| 48周减重
| 恶心发生率
| 呕吐发生率
| |
4-8 mg剂量组
| -16.3%
| -21.8%
| 60%
| 26%
|
2-4-8-12 mg剂量组
| -15.8%
| -22.1%
| 45%
| 19%
|
事实上,国内外指南也在建议合理的不影响人体健康的“温柔”的减重速度才是最合理的减重速度。《成人肥胖食养指南(2024版)》指出,较为理想的减重目标应是6个月内减少当前体重的5%~10%,并建议减重初始的目标为每周约0.5 kg。《欧洲体重管理指南》也指出,每周0.5 kg~1 kg减重,6个月达到5~15%是合理的,这与GLP-1 RA的开发策略相辅相成。图6展示了甘李药业GZR18与替尔泊肽中国试验减重曲线的对比,可以看出,GZR18的减重曲线一直平稳持续下降,速度合理,并无显著平台期,显示了GZR18采用了正确合理的临床剂量设计策略。
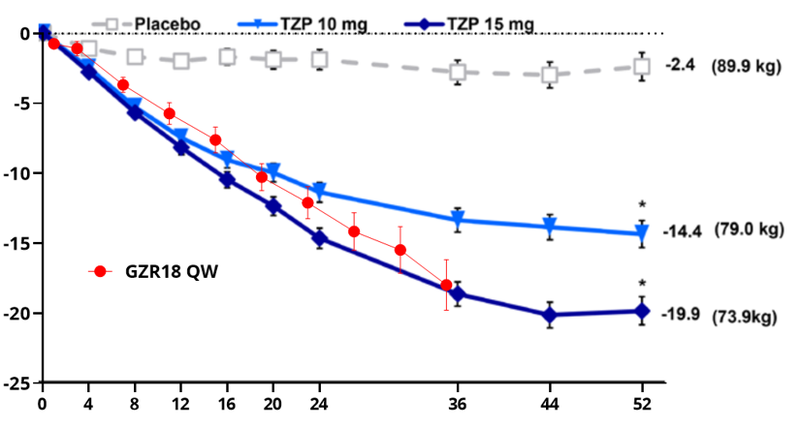
图6 GZR18与替尔泊肽减重曲线对比图[10]
总之,甘李药业的GZR18值得期待,根据披露的信息,甘李药业正在进行GZR18注射液II期临床试验,从GLP-1 RA的开发策略出发,既探索了更宽的剂量范围,同时进一步探索了两周一次给药的减重效果。预计该试验结果能够进一步验证GZR18的药效潜力,期待GZR18双周制剂的药效突破现有数据,为GLP-1 RA赛道带来更大的惊喜。
[1] Wilding JPH, Batterham RL, Calanna S, et al. Once-Weekly Semaglutide in Adults with Overweight or Obesity.N Engl J Med. 2021;384(11):989-1002. doi:10.1056/NEJMoa2032183
[2] Jastreboff AM, Aronne LJ, Ahmad NN, et al. Tirzepatide Once Weekly for the Treatment of Obesity.N Engl J Med. 2022;387(3):205-216. doi:10.1056/NEJMoa2206038
[3] Frias JP, Deenadayalan S, Erichsen L, et al. Efficacy and safety of co-administered once-weekly cagrilintide 2·4 mg with once-weekly semaglutide 2·4 mg in type 2 diabetes: a multicentre, randomised, double-blind, active-controlled, phase 2 trial.Lancet. 2023;402(10403):720-730. doi:10.1016/S0140-6736(23)01163-7
[4] Jastreboff AM, Kaplan LM, Frías JP, et al. Triple-Hormone-Receptor Agonist Retatrutide for Obesity - A Phase 2 Trial.N Engl J Med. 2023;389(6):514-526. doi:10.1056/NEJMoa2301972
[5] Nauck MA, Quast DR, Wefers J, Meier JJ. GLP-1 receptor agonists in the treatment of type 2 diabetes - state-of-the-art.Mol Metab. 2021;46:101102. doi:10.1016/j.molmet.2020.101102
[6] Zhang B, Cheng Z, Chen J, et al. Efficacy and Safety of Mazdutide in Chinese Patients With Type 2 Diabetes: A Randomized, Double-Blind, Placebo-Controlled Phase 2 Trial.Diabetes Care. 2024;47(1):160-168. doi:10.2337/dc23-1287
[7] Pater C. Individualizing therapy - in search of approaches to maximize the benefit of drug treatment (II).Curr Control Trials Cardiovasc Med. 2004;5(1):7. Published 2004 Aug 16. doi:10.1186/1468-6708-5-7
[8] Zhang M, Zhang Y, Peng X, et al. GZR18, a novel long-acting GLP-1 analog, demonstrated positive in vitro and in vivo pharmacokinetic and pharmacodynamic characteristics in animal models.Eur J Pharmacol. 2022;928:175107. doi:10.1016/j.ejphar.2022.175107
[9] Clinical Guidelines on the Identification, Evaluation, and Treatment of Overweight and Obesity in Adults--The Evidence Report. National Institutes of Health [published correction appears in Obes Res 1998 Nov;6(6):464].Obes Res. 1998;6 Suppl 2:51S-209S.
[10] Zhao L, Cheng Z, Lu Y, et al. Tirzepatide for Weight Reduction in Chinese Adults With Obesity: The SURMOUNT-CN Randomized Clinical Trial.JAMA. Published online May 31, 2024. doi:10.1001/jama.2024.9217