在呼吸系统疾病诊疗领域,支气管扩张症、肺动脉高压、难治性慢性咳嗽、慢性鼻窦炎伴鼻息肉及中重度季节性过敏性鼻炎始终是临床治疗的重大挑战。近期,《新英格兰医学杂志》等国际权威期刊相继发布多项突破性研究成果,为这些顽固性疾病的治疗带来新曙光。本文将聚焦5类重磅新药的最新研究进展,为临床实践提供前沿视角。
1.Brensocatib治疗支气管扩张症的Ⅲ期临床研究
2.Sotatercept治疗高危肺动脉高压的生存获益研究
3.Camlipixant治疗难治性慢性咳嗽的Ⅱb期试验
4.特泽利尤单抗治疗CRSwNP的Ⅲ期研究
5.司普奇拜单抗治疗季节性过敏性鼻炎的Ⅲ期中国研究
Brensocatib:
降低支气管扩张症急性加重风险
中性粒细胞炎症是支气管扩张症急性加重的重要病理机制,与疾病进展风险增加密切相关。Brensocatib作为一种口服可逆性DPP-1抑制剂,通过抑制中性粒细胞丝氨酸蛋白酶(如中性粒细胞弹性蛋白酶)调控炎症反应。近日,Brensocatib治疗支气管扩张症的Ⅲ期临床研究(ASPEN研究)已发表于《新英格兰医学杂志》[1],进一步探究Brensocatib治疗中性粒细胞炎症支气管扩张症患者的疗效和安全性。

图1 ASPEN研究截图
ASPEN研究共纳入1721例患者(成人1680例,青少年41例),随机分为Brensocatib 10mg组、Brensocatib 25mg组、安慰剂组三组,以52周年化病情加重发生率为主要终点。按照分层检验顺序,次要终点分别为首次病情加重时间、52周无病情加重患者比例、第一秒用力呼气容积(FEV1)变化、严重病情加重年化发生率、生活质量评分变化。
Brensocatib 10mg组、Brensocatib 25mg组的年化病情加重发生率分别为1.02次/年和1.04次/年,显著低于安慰剂组(1.29次/年)。Brensocatib 10mg组首次病情加重时间的HR为0.81(95% CI 0.70~0.95,P=0.02),Brensocatib 25mg组的HR为0.83(95% CI 0.70~0.97,P=0.04)。
治疗52周,Brensocatib组无病情加重的患者比例为48.5%(10mg和25mg组均相同),安慰剂组为40.3%(与安慰剂组相比,Brensocatib 10mg组和Brensocatib 25mg组RR分别为1.20和1.18,P均<0.05)。第52周时,Brensocatib 10mg组、Brensocatib 25mg组和安慰剂组的FEV1分别下降了50mL、24mL和62mL。
此外,各组的其他不良事件发生率相似。
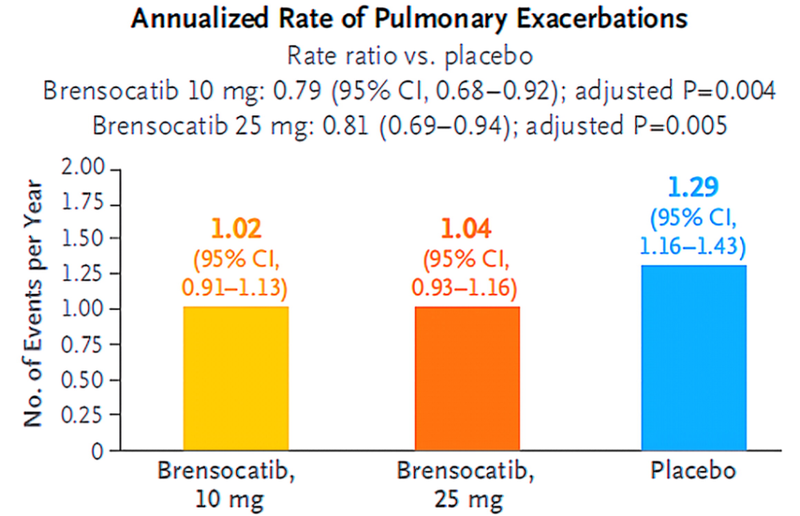
图2 年化病情加重发生率
研究表明,在支气管扩张症成人和青少年患者中,每日一次口服Brensocatib(10mg或25mg)治疗可显著降低急性加重风险。
Sotatercept:
高危肺动脉高压患者生存获益显著
Sotatercept是一种激活素信号抑制剂,用于治疗成人肺动脉高压(WHO功能分级Ⅰ级),以增加运动能力,改善WHO功能分级,降低临床恶化事件的风险,于2024年3月被FDA批准上市。近日,发表于《新英格兰医学杂志》的ZENITH研究[2],进一步探究Sotatercept在提高肺动脉高压功能分级Ⅲ级或Ⅳ级的高死亡风险成人的运动功能和降低死亡风险的疗效。

图3 ZENITH研究截图
ZENITH研究中期分析结果显示,Sotatercept与安慰剂相比,显著降低了肺动脉高压功能分级Ⅲ或Ⅳ级且死亡风险较高的成人患者死亡或疾病恶化事件的风险(事件包括全因死亡、肺移植和因肺动脉高压恶化导致住院超过24小时)。
Sotatercept组15例(17.4%)和安慰剂组47例(54.7%)发生至少1个主要终点事件(HR,0.24,95% CI 0.13~0.43,P<0.001)。Sotatercept组全因死亡患者7例(8.1%),安慰剂组全因死亡患者13例(15.1%);Sotatercept组和安慰剂组肺移植患者分别为1例(1.2%)和6例(7.0%);因肺动脉高压恶化而住院的患者分别为8例(9.3%)和43例(50.0%)。Sotatercept最常见的不良反应为鼻出血和毛细血管扩张。
表1 ZENITH研究中期结果
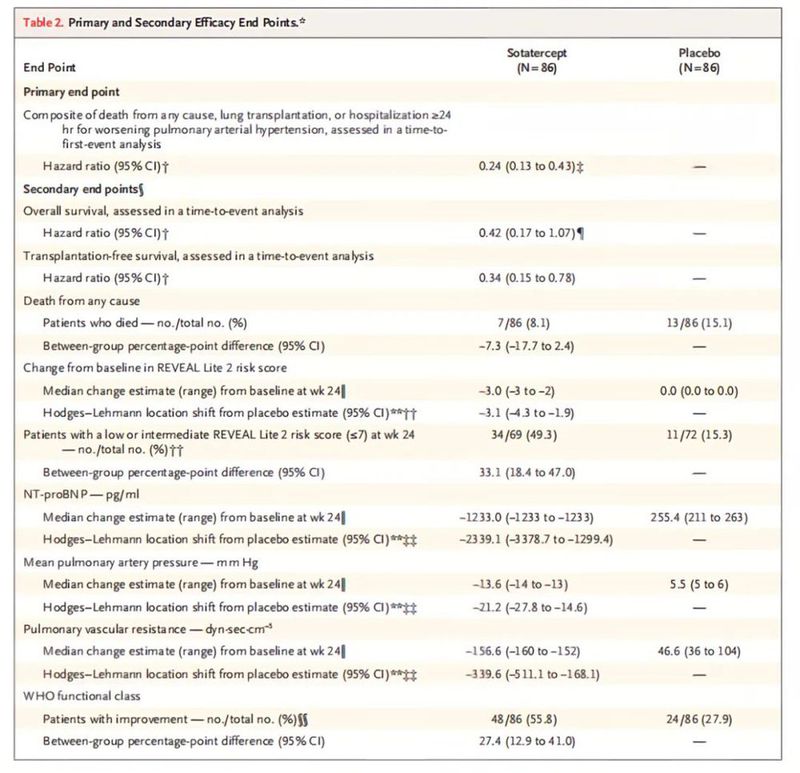
研究表明,在接受最大耐受剂量背景治疗的肺动脉高压高危成人患者中,与安慰剂相比,Sotatercept治疗可降低全因死亡、肺移植或因肺动脉高压恶化而住院(≥24小时)的复合风险。
Camlipixant:
成人难治性慢性咳嗽口服药物新进展
Camlipixant是一种选择性口服P2X3受体拮抗剂,用于成人难治性慢性咳嗽的治疗,目前正处于临床Ⅲ期开发阶段。

图4 SOOTHE研究截图
SOOTHE研究是一项camlipixant治疗难治性慢性咳嗽的Ⅱb期临床试验[3],共纳入了310名咳嗽时间≥1年、基线清醒咳嗽频率≥25小时的难治性慢性咳嗽患者,患者随机接受安慰剂或三个不同剂量的camlipixant(12.5mg bid、50mg bid和200mg bid)。
结果显示:和安慰剂组相比,camlipixant 50mg组(-34.4%)和200mg组(-34.2%)的安慰剂校正后24小时咳嗽频率均出现统计学显著降低(P均<0.005)。所有camlipixant剂量组在咳嗽严重程度视觉模拟评分(VAS)和莱斯特咳嗽问卷(LCQ)方面均显示出优于安慰剂的改善趋势。Camlipixant耐受性良好,未报告严重治疗相关不良事件。4.8%~6.5%的camlipixant组患者出现味觉相关不良事件(<6.5%,安慰剂组为0%),均为轻到中度。
特泽利尤单抗:
同时改善CRSwNP合并哮喘患者的上下气道症状
慢性鼻窦炎伴鼻息肉(CRSwNP)是一种异质性的上气道炎症性疾病,其主要特征包括上皮屏障功能障碍,以及以胸腺基质淋巴细胞生成素(TSLP)和白介素-33(IL-33)等上游上皮细胞因子介导的2型炎症机制。目前常用的治疗手段包括鼻用糖皮质激素,但其对鼻息肉体积及症状改善的效果有限。对于重度复发性CRSwNP患者,可能需要多次鼻窦手术或使用系统性糖皮质激素治疗。2025年3月,《新英格兰医学杂志》发表了WAYPOINT研究的主要结果[4],展示了特泽利尤单抗(Tezepelumab,抗TSLP单抗)在CRSwNP领域的治疗潜力。
图5 WAYPOINT研究截图
WAYPOINT研究是一项多中心、随机、双盲、安慰剂对照Ⅲ期试验[4],纳入408例重度CRSwNP成人患者(≥18岁),按1:1随机分组,接受特泽利尤单抗210 mg或安慰剂皮下注射(每4周1次,持续52周)。共同主要终点为第52周时总鼻息肉评分(NPS)和双周平均鼻塞评分(NCS)较基线的变化。预设亚组分析评估合并哮喘共病患者的NPS、NCS、FEV1(关键次要终点)及ACQ-6评分(次要终点)。
与安慰剂组相比,特泽利尤单抗组在第一次治疗后的NPS和NCS评估(第4周和第2周)即可观察到改善。至第52周,特泽利尤单抗组患者的NPS[−2.07(95%CI −2.39,−1.74)]和NCS [−1.03(95%CI −1.20,−0.86)] 显示出持续改善。此外,特泽利尤单抗组嗅觉丧失评分改善更显著[−1.00(95%CI −1.18,−0.83)],且显著降低了鼻窦炎手术的需求 [RR 0.02(95%CI0.00,0.09];P<0.001]。
此外,5月份的ATS国际大会公布了对WAYPOINT研究中合并哮喘患者的进一步分析[5]。基线时,合并哮喘共病患者的平均(标准差,SD)FEV1为2.89(0.89)L,相当于预计值的85.8%(16.4),ACQ-6平均评分为1.82(1.16)。第52周时,特泽利尤单抗治疗在合并哮喘组及不合并哮喘组总NPS、NCS的改善均优于安慰剂(图6);在合并哮喘患者中,FEV1维持稳定(组间无显著差异),特泽利尤单抗组ACQ-6评分优于安慰剂组;总体人群中,安慰剂组哮喘急性发作率高于特泽利尤单抗(5.9% vs 0.5%)。
该研究结果表明,特泽利尤单抗显著改善了合并或不合并哮喘共病的重度CRSwNP患者的上呼吸道症状(包括NP体积缩小)及患者报告的鼻塞评分。在合并哮喘的患者中,特泽利尤单抗同步改善了哮喘控制,提示其对下呼吸道症状亦有积极影响。
司普奇拜单抗注射液:
中国原研IL-4Rα抑制剂惠及过敏性鼻炎患者
司普奇拜单抗注射液(Stapokibart)是我国自主研发的用于治疗成人中重度特应性皮炎、慢性鼻窦炎伴鼻息肉和季节性过敏性鼻炎,也是目前全球首个获批治疗季节性过敏性鼻炎(SAR)的IL-4Rα生物制剂。
为研究Stapokibart在成人中重度季节性过敏性鼻炎附加治疗的有效性和安全性,近日由中国学者完成的一项Ⅲ期多中心、随机、双盲、安慰剂对照临床研究结果在线发表[6]。

图7 研究截图
该研究共纳入108例诊断为中重度季节性过敏性鼻炎且基线血嗜酸性粒细胞计数≥300/μL的患者。受试者被随机(1:1)接受600mg(负荷剂量)至300mg Stapokibart皮下注射或安慰剂,每2周1次,共4周。主要研究终点为前2周每日反射性总鼻症状评分(rTNSS)较基线的平均变化。多重检验的次要终点包括4周以上的rTNSS变化、2周和4周的反射性总眼部症状评分和鼻结膜炎生活质量问卷评分。结果显示,Stapokibart对中重度季节性过敏性鼻炎患者的鼻部和眼部症状及生活质量均有改善作用,且安全性良好。
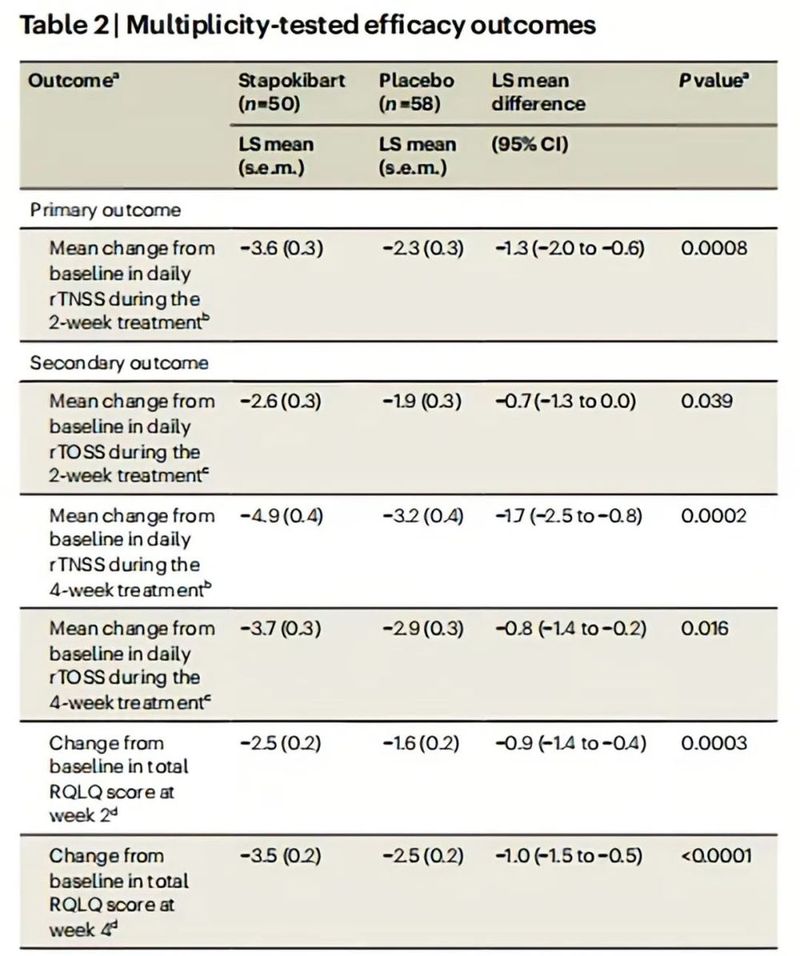
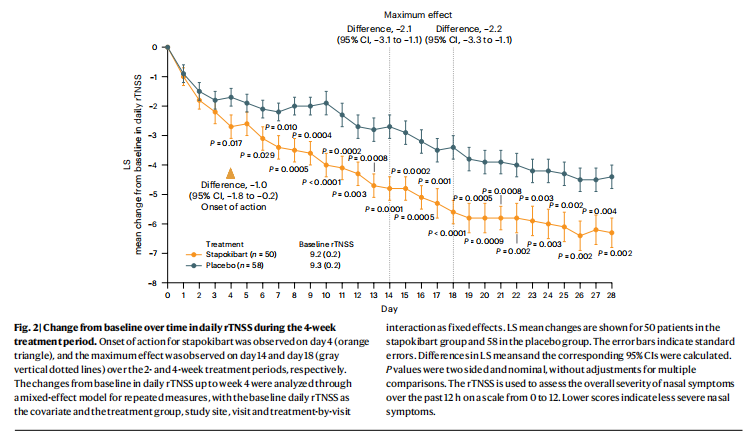
图8 4周治疗期间每日rTNSS较基线随时间的变化
小结
上述研究展现了呼吸领域新药研发正在突破传统治疗路径向“机制靶向”转型的缩影。持续关注新药进展,共同推动呼吸治疗优化,为患者带来临床获益。
[1]Chalmers JD, Burgel PR, Daley CL, et al. Phase 3 Trial of the DPP-1 Inhibitor Brensocatib in Bronchiectasis. N Engl J Med. 2025;392(16):1569-1581.
[2]Humbert M, McLaughlin VV, Badesch DB, et al. Sotatercept in Patients with Pulmonary Arterial Hypertension at High Risk for Death. N Engl J Med. Published online March 31, 2025.
[3]Smith JA, Birring SS, Blaiss MS, et al. Camlipixant in Refractory Chronic Cough: A Phase 2b, Randomized, Placebo-controlled Trial (SOOTHE). Am J Respir Crit Care Med. Published online March 5, 2025.
[4]Lipworth BJ, Han JK, Desrosiers M, et al. Tezepelumab in Adults with Severe Chronic Rhinosinusitis with Nasal Polyps. N Engl J Med. 2025;392(12):1178-1188.
[5]Desrosiers M, et al. Efficacy of Tezepelumab on Upper and Lower Airway Outcomes in Adults With Severe, Uncontrolled Chronic Rhinosinusitis With Nasal Polyps in Patients With and Without Comorbid Asthma: Results From the Phase 3 Waypoint Study. Am J Respir Crit Care Med 2025;211:A5547.
[6]Zhang Y, Li J, Wang M, et al. Stapokibart for moderate-to-severe seasonal allergic rhinitis: a randomized phase 3 trial. Nat Med. Published online April 4, 2025.