2024年6月11日,拜耳在Clinicaltrials.gov网站上注册了BAY 2927088一线治疗HER2激活突变非小细胞肺癌的三期临床试验。
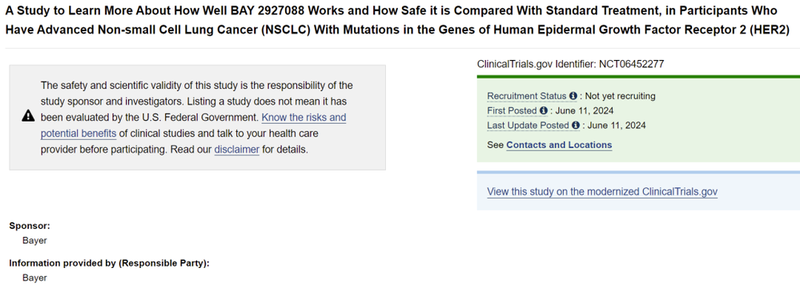
该三期临床计划入组278例HER2激活突变、局部晚期非小细胞肺癌患者,预计2026年6月初步完成。
该三期临床以PD-1+化疗的标准疗法为对照,进行头对头试验。
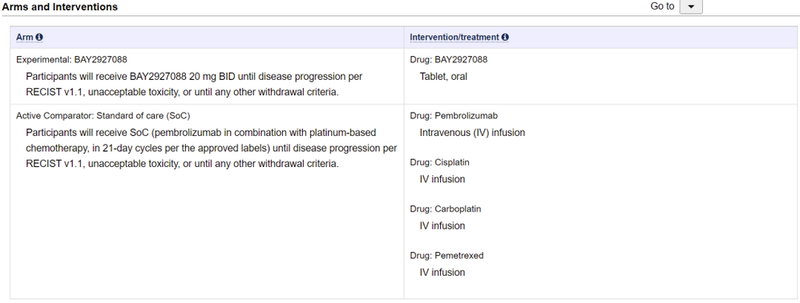
BAY 2927088为一款mEGFR/HER2小分子抑制剂。

EGFR突变为非小细胞肺癌最常见的基因突变,通常为Exon19和Exon21,但Exon20的多种突变往往对EGFR-TKI不敏感。2021年,FDA先后批准EGFR/cMET双抗、武田TAK-788用于治疗EGFR exon20ins的非小细胞肺癌患者。
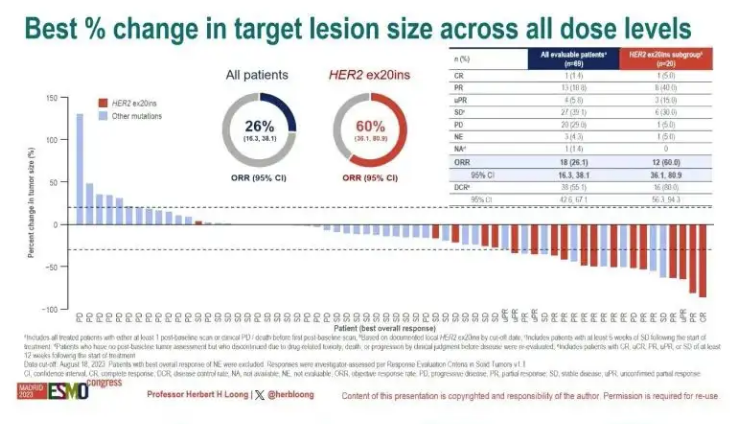
2023年ESMO会议上,拜耳公布了BAY 2927088后线治疗EGFR/HER2突变NSCLC的1/2期临床数据,总体ORR为26%,其中HER2 20号外显子插入突变患者(n = 20)的ORR为60%。2024年2月26日,BAY2927088获得FDA的突破疗法认证,用于治疗携带HER2激活突变的非小细胞肺癌患者。因此该三期临床限定在HER2激活突变的NSCLC患者。
总结
HER2激活突变占到非小细胞肺癌患者的2-4%,目前还缺乏FDA完全批准的治疗方案。拜耳在竞争激烈的EGFR exon20ins之外,找到了HER2 exon20ins这一突破口。