▎Armstrong
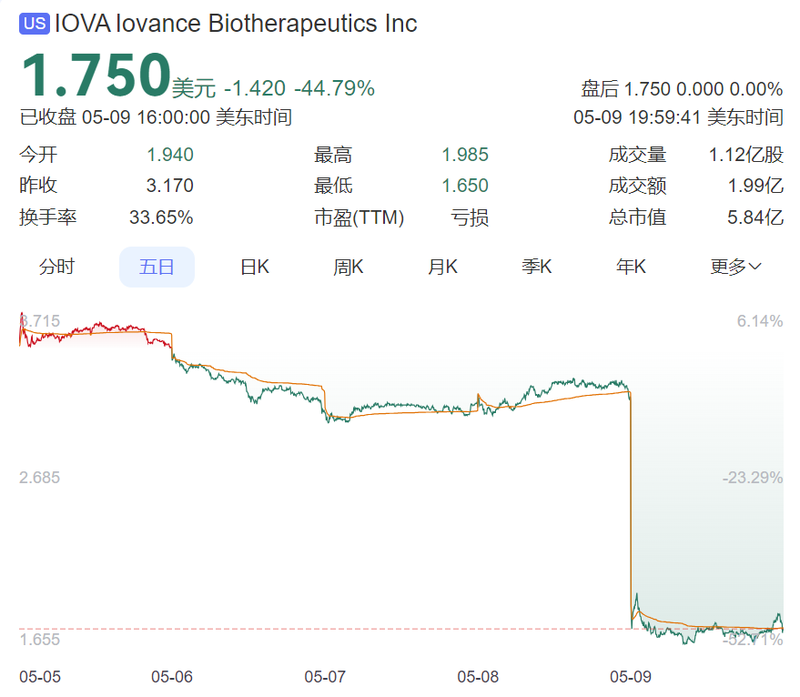
2025年5月8日,Iovance Biotherapeutics公布一季度财报,首款TIL疗法Amtagvi一季度销售额4360万美元,与去年四季度的4870万美元环比下降10%,同时2025年的收入指引从此前的4.50-4.75亿美元下调至2.50-3.00亿美元。受此消息影响,Iovance Biotherapeutics当天股价大跌45%,目前市值为5.84亿美元。
不可否认,Amtagvi为全球范围内首款获批上市的TIL疗法,给后线晚期黑色素瘤患者带来深度且持久的临床获益(ORR为31.4%,随访48个月仍未达到mDOR,4年OS率达21.9%)。同时,Amtagvi代表着细胞疗法对于实体瘤的突破,对于整个TIL赛道的发展也有着重要意义。



不过,由于Amtagvi本身过于复杂的工艺和治疗方案,以及副作用大的挑战,为其临床渗透带来了巨大挑战,正是这些问题导致Amtagvi市场表现显著不及预期。

Amtagvi的体外制备周期需要22天,依赖于IL-2的扩增,患者给药前需要严格的清淋,给药后需要继续注射IL-2以保证TIL的体内扩增。
深度清淋,以及IL-2的合并使用,让Amtagvi的安全性风险很大,死亡副作用高达7.5%,引起死亡的副作用包括严重感染、体内器官出血、急性肾衰、急性呼吸衰竭、心律失常、大量腹水、肝损伤、骨髓衰竭等。ICU住院率高达23.6%,3/4级副作用高达94.9%。

这些严重副作用也写在了Amtagvi说明书的黑框警告中,Amtagvi也被严格限制只能在具备ICU设施并有熟练使用心肺或者重症监护药物的专家的医疗机构内使用。根据Iovance统计的70家ATC情况,超过一半的患者都集中在9家ATC接受治疗,意味着对临床应用端有极高要求,不利于推广。

在治疗费用方面,Amtagvi的定价为51.5万美元,加上IL-2的治疗费用,以及住院和特殊护理费用,Amtagvi的总和治疗成本已经接近100万美元,即便在欧美发达国家,仍然是巨大的负担。
2025年一季度,Amtagvi销售额4360万美元(意味着治疗了85例患者),而一季度的直接销售成本(COGS)即高达4297.5万美元,意味着Amtagvi的生产成本和其他直接成本大概率也高达几十万美元。

TIL疗法的临床价值已经得到验证,但在成本、安全性方面仍然有极大的改善空间。与此同时,国内的TIL疗法生物技术公司正在进行更积极的技术创新和快速的临床开发。君赛生物、沙砾生物、循生生物、智瓴生物、蓝马医疗、华赛伯曼等陆续进入临床阶段,其中君赛生物、沙砾生物已经在进行注册性关键临床。
沙砾生物GT101已经进入关键注册临床,用于治疗复发性或转移性宫颈癌。GT101在一期临床中表现出优异的疗效潜力,尤其是11例宫颈癌患者,ORR为45.5%,DCR高达90.9%,副作用主要与氟达拉滨/环磷酰胺(FC)清淋方案以及IL-2相关。

华赛伯曼的TIL疗法HS-IT101正在进行黑色素瘤一期临床,并获得初步数据。华赛伯曼的FAST-TIL技术组织需求量减少到0.05g,培养周期缩短至14天,临床IL-2用量降低至1/25,表现出比较好的耐受性。

2024年底,君赛生物GC101启动黑色素瘤注册性关键二期临床试验。君赛生物采用全新的工艺和技术,体外扩增阶段不需要使用滋养细胞,仅使用低剂量的IL-2,患者给药前仅需要轻度清淋方案,患者给药后则不需要任何剂量的IL-2。君赛生物的新工艺大幅降低了生产成本,同时TIL摆脱IL-2依赖,安全性大幅提升,无需重症监护,全方位优势为扩大TIL疗法应用场景、提高渗透率奠定了基础。
2024年5月,君赛生物IL-2非依赖性TIL疗法,辅以25%标准剂量PD-1单抗治疗妇科肿瘤的初步临床数据发表在BMC Medicine期刊上,14例标准治疗失败(平均前线治疗线数为3.4)的晚期妇科肿瘤患者,疾病控制率78.6%,客观缓解率35.7%,最长的CR患者,已无瘤生存超3年。14例患者中,2例子宫内膜癌患者全部达到CR,5例宫颈癌患者中2例达到PR。值得注意的是,该研究中受试患者中位ECOG评分为2,对大剂量化疗清淋与IL-2注射的耐受度低。


2024年ASCO会议上,君赛生物披露了非病毒载体基因修饰的TIL疗法GC203治疗复发性卵巢癌的初步临床数据,18例患者中2例达到CR,4例达到PR,9例SD,ORR达到33.3%,DCR高达83.3%。

更重要的是,在取得优异疗效的前提下,君赛生物的TIL疗法在安全性上取得压倒性优势。GC101治疗泛瘤种的ORR超过35%,GC203治疗卵巢癌的ORR为33.3%。除Iovance证明过的黑色素瘤、非小细胞肺癌、宫颈癌、头颈部鳞癌、子宫内膜癌外,在胰腺癌、高级别脑胶质瘤、胆管细胞癌、卵巢癌等难治性肿瘤上也展现优异临床潜力。安全性方面,Amtagvi最严重的死亡(7.5%)、感染(26.9%)、ICU入住率(23.6%)、毛细血管渗漏综合征(13.5%)等副作用,在君赛生物的产品中均未观察到,患者可在普通病房里接受治疗,无需使用ICU病房,住院周期从20-30天缩短至7天,大大拓宽了临床机构范围,提高了病房周转速度。

GC101黑色素瘤注册性关键二期临床只需要入组78例,主要终点为PFS,意味着GC101有望快速上市成为首款国产TIL疗法。根据已经公开的妇科肿瘤临床数据,君赛生物新TIL技术平台在有效性、安全性、成本等多个维度展现出了全方位的优势,临床应用场景得到最大程度的扩展,也意味着其有明确的国际化潜力和巨大的商业化潜力。
可以看到,TIL的安全性很大程度上来源于深度清淋方案和IL-2。华赛伯曼的减量IL-2,君赛生物完全不用IL-2,极大程度上提高了TIL疗法的安全性,从而提高治疗窗以达到更好的疗效。同时,也可以助推TIL疗法向前线拓展,以及开展广泛的联合治疗探索。成本控制、安全性的提升,将极大提高TIL疗法的可及性,有望拓展至多种实体瘤,商业化前景值得期待。



Armstrong技术全梳理系列
和铂医药技术全梳理; 荣昌生物技术全梳理; 再鼎医药技术全梳理; 药明生物技术全梳理; 恒瑞医药技术全梳理; 豪森药业技术全梳理; 正大天晴技术全梳理; 吉凯基因技术全梳理; 基石药业技术全梳理; 百济神州技术全梳理; 百济神州技术全梳理第2版; 信达生物技术全梳理; 信达生物技术全梳理第2版; 中山康方技术全梳理; 复宏汉霖技术全梳理; 先声药业技术全梳理; 君实生物技术全梳理; 嘉和生物技术全梳理; 志道生物技术全梳理; 道尔生物技术全梳理; 尚健生物技术全梳理; 康宁杰瑞技术全梳理; 科望医药技术全梳理; 岸迈生物技术全梳理; 礼进生物技术全梳理; 康桥资本技术全梳理; 余国良的抗体药布局; 荃信生物技术全梳理; 安源医药技术全梳理; 三生国健技术全梳理; 仁会生物技术全梳理; 乐普生物技术全梳理; 同润生物技术全梳理; 宜明昂科技术全梳理; 派格生物技术全梳理; 迈威生物技术全梳理; Momenta技术全梳理; NGM技术全梳理; 普米斯生物技术全梳理; 普米斯生物技术全梳理2.0; 三叶草生物技术全梳理; 泽璟制药抗体药全梳理; 恒瑞医药抗体药全梳理; 齐鲁制药抗体药全梳理; 石药集团抗体药全梳理; 豪森药业抗体药全梳理; 华海药业抗体药全梳理; 科伦药业抗体药全梳理; 百奥泰技术全梳理; 凡恩世技术全梳理。