迈威生物成立于2017年,成立七年多以来,已有14款研发管线进入临床阶段,覆盖肿瘤、自免、代谢、眼科、感染五大治疗领域,药物形式覆盖单抗、双抗、ADC、重组蛋白等。
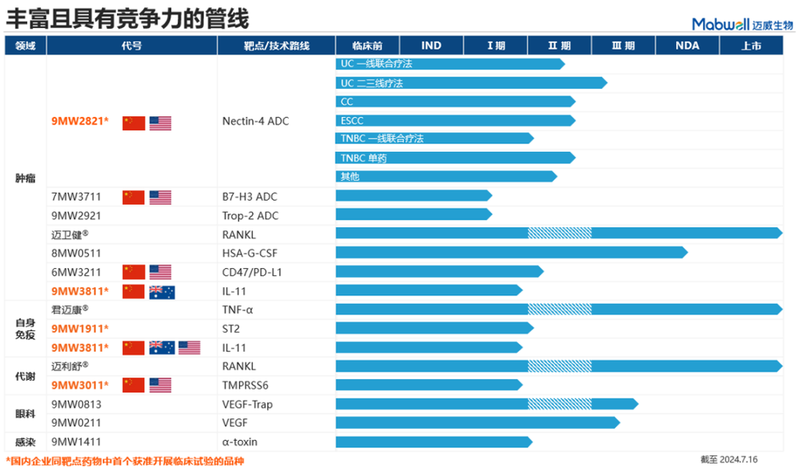
9MW2821:首款国产Nectin-4 ADC
9MW2821基于其IDDC定点偶联技术平台开发,经过充分的差异化设计,采用可专利的桥连子及经过优化的偶联反应条件,实现定点修饰。三阴性乳腺癌动物模型中显示其抗肿瘤活性优于已上市的Padcev,在食蟹猴、小鼠体内的安全性均优于Padcev。
9MW2821为首款进入三期临床的国产Nectin-4 ADC,2023年12月,迈威生物注册了Nectin-4 ADC新药9MW2821的三期临床试验,用于治疗局部复发性或转移性尿路上皮癌。
9MW2821在适应症拓展方面同样推进迅速。2024 年 2 月,获 FDA 授予快速通道认定用于治疗晚期、复发或转移性食管鳞癌;5 月,先后获孤儿药认定和快速通道认定用于治疗食管癌和既往接受过含铂化疗方案治疗失败的复发或转移性宫颈癌;7 月,获快速通道认定用于治疗局部晚期或转移性 Nectin-4 阳性三阴性乳腺癌。多项审评资质的获得也提示了美国在该些适应症的治疗新手段的稀缺。
临床表现方面,9MW2821 是全球首个在宫颈癌、食管癌以及乳腺癌适应症披露临床有效性数据的靶向Nectin-4 的治疗药物,截至2024年5月23日,目标剂量下累计入组已超过350 例。根据其在2024 ASCO大会发布的数据,II 期临床 1.25mg/kg 剂量组的 240 例患者中,37 例尿路上皮癌患者ORR和DCR分别为62.2%和91.9%,mPFS为8.8个月,mOS为14.2个月。53 例宫颈癌患者ORR和DCR分别为35.8%和81.1%,mPFS为3.9个月,mOS尚未达到。Nectin-4肿瘤细胞染色强度 3+ 的39例宫颈癌患者ORR为 43.6%。39 例食管癌患者ORR和DCR分别为23.1%和69.2%,mPFS 为3.9个月,mOS为8.2个月。20 例局部晚期或转移性三阴性乳腺癌患者ORR和DCR分别为50.0%和80.0%,mPFS 为 5.9 个月,mOS 尚未达到。
此外,9MW2821联合 PD-1 一线疗法已针对尿路上皮癌和三阴性乳腺癌分别开展临床试验。宫颈癌、食管癌、三阴性乳腺癌单药治疗均处于II期临床。四大适应症截止到今年年底前有望全面覆盖从一线到二三线患者群体的临床研究。
基于在ADC领域的持续探索,迈威生物后续还布局了Trop2 ADC、B7H3 ADC。两款产品均进入临床阶段,2023年9月完成首例患者给药,其中B7H3 ADC已获批在美国开展临床试验,并于2024年7月获 FDA授予孤儿药认定,用于治疗小细胞肺癌。考虑到其自有技术平台带来的源头创新研发能力,预计未来将有更多ADC产品进入临床试验阶段。
9MW1911:国内首款、全球第二款同靶点药物
9MW1911 是国内首家,全球进度处于第二梯队的靶向ST2单抗创新药,在慢性阻塞性肺疾病(COPD)适应症具有较大市场潜力,目前处于Ib/IIa期临床阶段。全球最领先开发进度为III期临床研究阶段。
临床前研究表明9MW1911 在分子水平上表现出与重组人 ST2 具有高亲和力,同时可以高效阻断 IL-33 与 ST2 的结合,抑制NF-kB 和 MAPK 信号通路的活化,进而抑制 Th2 细胞因子的产生;在细胞学水平上,9MW1911 可以抑制重组人 IL-33 促进 KU812 细胞生成 IL-5 的活性,表现出阻断IL-33/ST2 信号通路的作用;种属交叉试验显示,9MW1911 可以特异性结合人和食蟹猴ST2,与小鼠 ST2 不结合;非临床研究显示该品种动物体内作用机制清晰明确,与 ST2 特异性结合后,能够阻断细胞因子 IL-33 对 ST2 介导的信号通路的激活,抑制炎症反应的发生,从而实现对多种自身免疫性疾病的治疗。9MW1911所针对的 IL33/ST2 通路,系赛诺菲已上市药品Dupilumab(度普利尤单抗注射液,达必妥)所针对的IL-4/IL-13 信号传导通路的上游通路,具有更广泛的抗炎症反应。
目前全球尚无以ST2 或其配体 IL-33 为靶点的抗体药物上市。其2023年年度报告显示,9MW1911已完成健康受试者的 Ia 期临床试验,结果显示 9MW1911 注射液在剂量递增范围内安全且耐受性良好。
COPD赛道上,欧洲最新获批的度普利尤(IL-4R)所针对的COPD分型为II型炎症性患者,主要监测指标是嗜酸粒细胞大于等于300个,据报道这部分人群仅占到COPD全人群的31%左右。因此,COPD仍有巨大市场。目前有三款药物在COPD临床III期研究阶段:1)赛诺菲/再生元开发的IL-33抗体;2)MedImmune/阿斯利康共同开发的IL-33抗体;3)安进/基因泰克(Roche)开发的ST-2抗体。
9MW3011由迈威生物自主研发,是一款针对全新靶点TMPRSS6的单抗新药。作用机制上,9MW3011通过结合肝细胞表面表达的TMPRSS6,上调肝细胞表达铁调素的水平,抑制铁的吸收和释放,从而达到调节体内铁稳态的作用。
2023年1月,迈威生物就 9MW3011 项目与DISC达成独家许可协议,迈威生物可获得合计最高达 4.125 亿美元的首付款及里程碑付款,另外可获得许可产品净销售额最高近两位数百分比的特许权使用费,其中 DISC向迈威生物支付一次性不可退还的首付款 1000 万美元。2023年9月和2024年2月获FDA授予快速通道认定和孤儿药认定,用于治疗真性红细胞增多症。
2024年1月31日,武田引进Protagonist Therapeutics在研的铁调素(Hepcidin)类似物Rusfertide,武田获得一半美国商业权益,以及美国外商业权益。根据协议,武田支付3亿美元预付款,额外的里程碑金额以及美国外的销售分成。同作为铁稳态调节药物,9MW3011也具有巨大的潜在临床价值和商业价值。
9MW3811:国内首款IL-11抗体
IL-11在多种疾病的发病机制中扮演重要角色,从1989年克隆其基因以来,科学界对该靶点研究的越来越深入。9MW3811已在澳、中、美三地获批开展临床试验,是国内企业开发的首个获批进入临床的抗IL-11 单抗。9MW3811可高效阻断 IL-11 下游信号通路的活化,抑制 IL-11 诱导的病理生理功能,从而达到对纤维化和肿瘤的治疗效果。
除上述管线外,迈威生物还有肿瘤免疫的PD-L1/CD47双抗、抗感染的α-toxin抗体9MW1411等品种处于II期临床阶段。
商业化阶段产品:地舒单抗、阿达木单抗
迈威生物在生物类似药领域布局颇多,地舒单抗、阿达木单抗均已获批上市,2023年12月继续纳入医保目录。地舒单抗还被纳入《中国临床肿瘤学会 (CSCO) 乳腺癌诊疗指南 2024》。国际化方面也在快速推进,地舒单抗在12个国家达成正式协议,在巴基斯坦提交上市申请;阿达木单抗在13个国家达成正式协议,并在印尼、巴基斯坦和埃及提交上市申请;阿柏西普眼内注射液在1个国家达成正式协议。
2023年12月,迈威生物长效G-CSF 8MW0511的上市申请也获得NMPA受理,用于成年非髓性恶性肿瘤患者在接受容易引起发热性中性粒细胞减少症的骨髓抑制性抗癌药物治疗时,使用本品降低以发热性中性粒细胞减少症为表现的感染发生率。
阿柏西普类似药9MW0813处于三期临床阶段,也已开展海外合作。在眼科领域,迈威生物还布局了VEGF-A特异性和高亲和力的抗体9MW0211,同样已经进入三期临床。
总结
迈威生物经过7年多发展建立起具有竞争力的差异化创新管线和生物类似药管线。创新药方面,重点布局ADC领域,在Nectin-4 ADC的部分适应症赛道已位居全球首位,逐渐完成从后线到前线的覆盖,尤其在三阴性乳腺癌领域具备先发优势;抗TMPRSS6单抗项目完成高额海外授权;重点品种抗ST2单抗、抗IL-11抗体目前全球均尚无优效的治疗手段获批,市场潜力巨大。随着9MW2821四大适应症的陆续明确和数据披露,以及对公司研发平台实力的验证,相信迈威生物将能够释放更多潜力。生物类似药方面,产品陆续上市,并广泛开拓海外国家合作。两条业务发展路线相辅相成,未来前景可期。
参考材料
迈威生物官网;
Iron metabolism and iron disorders revisited in the hepcidin era.