糖尿病肾病(DN)是糖尿病微血管并发症中最常见的一种,波及全球约2.5亿患者。其发病机制极为复杂,涵盖了脂质代谢紊乱、血流动力学异常、炎症与氧化应激、细胞损伤及凋亡等多个方面。尽管在治疗领域已取得显著进展,DN演变为终末期肾病(ESRD)的情况在众多案例中仍然难以避免。因此,深入理解DN的确切发病机制,并开发出能够有效减缓或逆转其进程的新疗法,显得尤为迫切。
在DN中,由炎症引起的足细胞损伤及细胞凋亡长期以来被视为导致蛋白尿和肾小球硬化的主要因素,这为开发新的治疗策略提供了可能。Toll样受体(TLRs)属于先天免疫系统中一类保守的模式识别受体,其中TLR4是最早被识别且研究最为深入的成员。TLR4的过度表达通过MyD88依赖的方式激活NF-κB炎症信号通路的下游组分,导致促炎细胞因子如IL-6、IL-1β和TNF-α的释放,从而加剧免疫反应。越来越多的证据显示,高血糖是DN进展的关键启动因素,而TLR4/MyD88/NF-κB信号通路在炎症损伤和纤维化进展中扮演着核心角色。
连翘脂素(PHI),是从连翘中提取所得。研究指出,PHI展现出多种药理活性,涵盖抗炎、抗氧化、抗糖尿病以及抗高脂血症等功效。特别值得关注的是,这些药理特性可能有助于降低肾脏疾病的发生风险。尽管如此,PHI在肾脏保护方面的具体作用机制尚需进一步明确。
日前,一篇名为“Phillygenin improves diabetic nephropathy by inhibiting inflammation and apoptosis via regulating TLR4/MyD88/NF-κB and PI3K/AKT/GSK3β signaling pathways”的研究论文评估了PHI对DN的治疗效果,并阐明其分子机制。

图1 论文首页
PHI抑制HG诱导的足细胞凋亡
先前的研究证实,LP(氯沙坦钾)能够降低血压和蛋白尿水平,进而减轻DN患者的肾脏损伤(图2A)。CCK-8实验结果显示,在高糖刺激48小时后,随着LP浓度的提升,MPCs的存活率逐渐增加(图2B)。此外,为探究PHI对高糖诱导的细胞损伤及凋亡的影响,研究使用western印迹分析检测了MPCs中足细胞蛋白、结蛋白、前半胱天冬酶-3和裂解的半胱天冬酶-3的表达水平(图2C),结果表明,PHI显著提升了HG培养的MPCs中足细胞蛋白和前半胱天冬酶-3的表达,同时降低了脱丝蛋白和裂解半胱天冬酶-3的表达。
同时,研究还通过细胞免疫荧光检测法检测了HG培养的MPCs中足细胞蛋白和脱丝蛋白的表达(图2D、E),结果与western印迹分析相一致。流式细胞术结果显示,在HG条件下,PHI显著抑制了小鼠细胞的凋亡(图2F)。这些结果强烈表明,PHI通过抑制DN小鼠足细胞损伤,具有显著的抗凋亡活性。


图2 PHI对HG诱导的足细胞凋亡的影响
PHI改善db/db小鼠肾功能,减轻肾小球损伤
为探究PHI对DN中肾损伤的保护作用是否与抑制炎症反应及足细胞凋亡紧密相关,研究采用db/db小鼠构建了DN小鼠模型,并以db/m小鼠作为对照组。如图3A所示,LP (20mg/kg,腹腔注射)、L-PHI (20mg/kg,胃内给药)或H-PHI(50mg/kg,胃内给药)分别对小鼠进行为期8周的治疗,期间每两周采集一次血液和尿液以测定血糖和UACR值。相较于db/m小鼠,db/db小鼠的血糖水平、体重及UACR显著升高。LP或H-PHI治疗显著降低了db/db小鼠的体重和UACR;然而,LP或H-PHI治疗对降低db/db小鼠的血糖水平无明显效果。此外,L-PHI治疗对这些参数在db/db小鼠中未见显著影响(图3B、C、D)。进一步地,肾脏/体重比值表明,LP和PHI均对DN具有肾保护作用,其中H-PHI治疗效果更为显著(图3E)。
继而,研究通过测定小鼠血清中炎症因子IL-1β、IL-6和TNF-α的浓度,评估了PHI对db/db小鼠肾炎的影响。ELISA结果显示,与未经处理的db/m小鼠相比,db/db小鼠体内促炎细胞因子如IL-1β、IL-6和TNF-α的产生显著增加。然而,PHI治疗显著抑制了db/db小鼠血清中IL-1β、IL-6和TNF-α的生成(图3F)。与db/m小鼠相比,HE和PAS染色显示db/db小鼠肾脏组织中肾小球明显肿胀、系膜细胞增殖和基质聚集,以及肾间质炎症细胞浸润(图3G);然而,LP或PHI治疗部分缓解了肾损伤的进展。此外,透射电镜结果显示,db/db小鼠的足细胞足突明显融合,肾小球基底膜(GBM)增厚,而LP或PHI治疗有效减轻了糖尿病肾损伤(图3H,I)。


图3 PHI改善了db/db小鼠的肾功能,减轻了肾小球损伤
PHI减轻db/db小鼠肾小球足细胞损伤和纤维化
免疫组织化学染色技术结果显示,α-SMA与FN作为肾纤维化之关键指标,在db/db小鼠体内表达水平显著高于db/m小鼠(图4A-B)。然而,经LP或PHI治疗后,db/db小鼠体内α-SMA与FN的表达水平显著降低。此外,免疫印迹检测揭示,db/db小鼠足细胞蛋白表达减少,而桥粒蛋白表达增加。LP或PHI治疗有效改善了这些变化,表明PHI能够减轻足细胞损伤(图4C)。同样,经LP或PHI治疗后,与凋亡相关的蛋白前半胱天冬酶-3表达显著上升,而裂解的半胱天冬酶-3表达显著下降,表明PHI具有减轻足细胞凋亡之功效(图4D)。


图4 PHI可减轻db/db小鼠肾小球足细胞损伤和纤维化
PHI对db/db小鼠TLR4/MyD88/NF-κB通路的影响
在体外实验结果的基础上,研究进一步探讨了PHI对TLR4/MyD88/NF-κB信号通路在体内作用的影响。通过免疫组织化学染色技术,研究观察到db/db小鼠体内TLR4、p-p65和p65的表达水平显著高于db/m小鼠。然而,经过LP和PHI处理后,这些蛋白在db/db小鼠中的过度表达得到了逆转,特别是H-PHI处理显著提升了这些蛋白的表达量(图5A)。此外,免疫印迹分析结果也证实了与db/m小鼠相比,db/db小鼠体内TLR4、MyD88、p-p65和p65的表达水平较高,而LP或PHI处理显著减轻了这种过度表达的效应(图5B)。

图5 PHI对db/db小鼠TLR4/MyD88/NF-κB通路的影响
PHI对db/db小鼠PI3K/AKT/GSK3β通路的影响
研究还进一步探讨了PHI在db/db小鼠中对PI3K/AKT/GSK3β信号通路的调节作用。结果显示,db/db小鼠体内p-PI3K、p-AKT及p-GSK3β的表达水平相较于db/m小鼠有所降低;然而,在LP或PHI处理后,这些变化显著减弱。进一步地,H-PHI在提升pPI3K、p-AKT和p-GSK3β表达方面展现出更为显著的潜力(图6A)。此外,免疫印迹分析结果也呈现出相似的趋势(图6B),表明PHI能够通过影响db/db小鼠PI3K/AKT/GSK3β信号通路的激活,从而缓解糖尿病肾损伤。
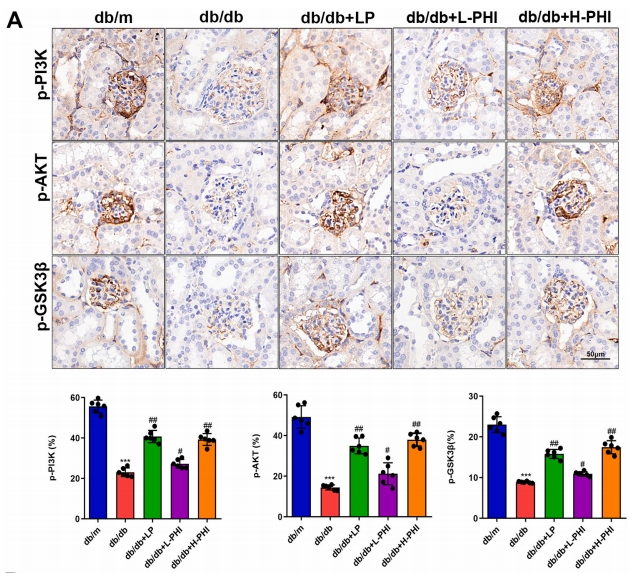

图6 PHI对db/db小鼠PI3K/AKT/GSK3#通路的影响