2024年6月7日,科伦博泰在Clinicaltrials.gov网站上注册了SKB264+Keytruda一线治疗PD-L1阳性非小细胞肺癌的国内三期临床试验。
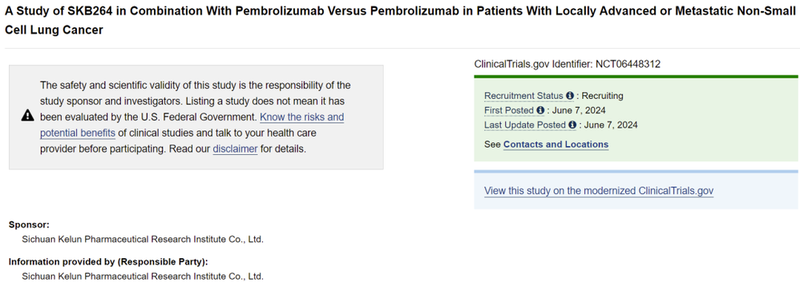
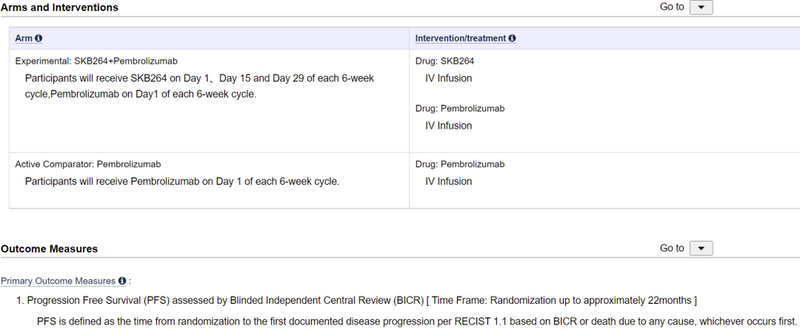
该三期临床计划入组406例PD-L1阳性晚期非小细胞肺癌患者,预计2026年11月完成。

该三期临床与Keytruda单药治疗头对头对照,主要终点为PFS。
SKB264此前关键临床分别针对三阴乳腺癌、EGFR突变非小细胞肺癌,此次SKB264-III-12的启动标志着进军非突变NSCLC的三期关键临床。
总结
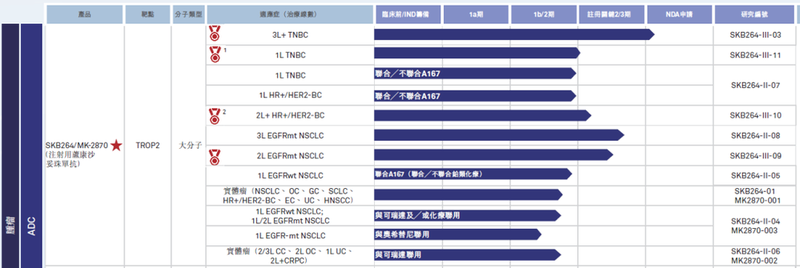
科伦博泰合作伙伴默沙东围绕SKB264已经启动9项全球三期临床,覆盖非小细胞肺癌、乳腺癌、子宫内膜癌、胃癌等多个癌种,涵盖后线和前线治疗。科伦博泰作为国内ADC的标杆性企业,在SKB264之后,还有Nectin-4 ADC、Claudin18.2 ADC等更多具有竞争力的ADC管线在积极推进中,期待其后续临床进展。
MK-2870-004:EGFR突变、且经过1或2种EGFR-TKI治疗以及1种铂类化疗治疗的非小细胞肺癌,556例;
MK-2870-005:晚期子宫内膜癌,710例;
MK-2870-007:PD-L1高表达(TPS≥50%)转移性非小细胞肺癌,614例;
MK-2870-009:EGFR突变、经EGFR-TKI治疗后进展的非小细胞肺癌,520例;
MK-2870-010:局部晚期或转移性HR+/HER2-乳腺癌,1200例;
MK-2870-012:辅助治疗既往经PD-1+化疗新辅助治疗术后未达到pCR的三阴乳腺癌,1530例;
MK-2870-015:复发性或转移性胃癌,450例;
MK-2870-019:辅助治疗既往接受新辅助Keytruda与含铂双药化疗且手术后未达到病理完全缓解的NSCLC患者(可切除的II期-IIIB期(N2)),780例;
MK-2870-023:一线治疗转移性非小细胞肺癌,851例。
合计6710例。