Teclistamab(商品名:TECVAYLI®),是首个用于治疗复发或难治性多发性骨髓瘤(RRMM)成年患者的现成皮下注射双特异性BCMA×CD3 T细胞接合剂,患者此前至少接受过4种治疗方案,包括一种蛋白酶体抑制剂(PI)、一种免疫调节剂和一种抗CD38单克隆抗体。
图片来源于智慧芽
尽管目前多发性骨髓瘤仍无法完全治愈,但借助化疗、蛋白酶体抑制剂、免疫调节剂、单克隆抗体等多种治疗手段,能够有效控制病情,显著延长患者的生存期并提升生活质量。然而,随着治疗的推进,患者可能会对多种治疗方案产生耐药性,这使得病情的持续控制变得更加复杂且充满挑战。
Teclistamab(特立妥单抗)

药物类型:双特异性T细胞结合器
靶点:BCMA(B细胞成熟抗原)和CD3(T细胞表面抗原)
作用机制:通过同时结合BCMA(在多发性骨髓瘤细胞表面高表达)和CD3(T细胞表面标志物),激活T细胞杀伤肿瘤细胞(见下图)。
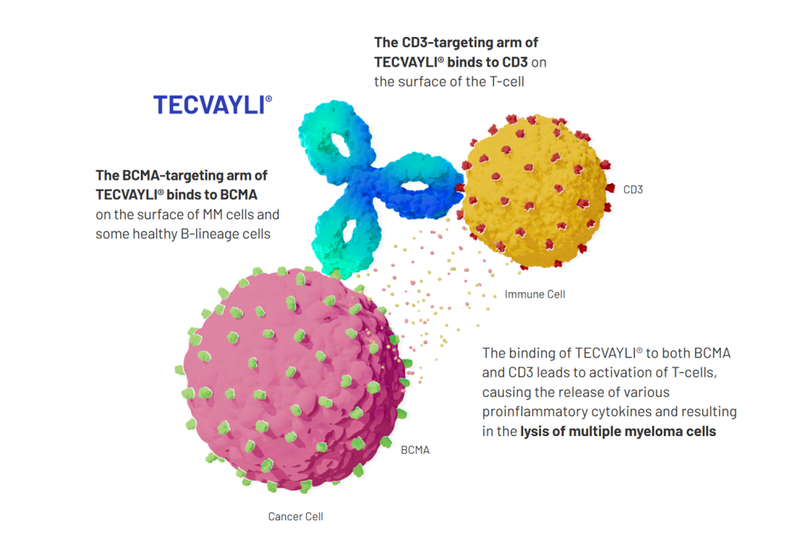
原研机构:Janssen Research & Development LLC
Teclistamab的分子结构
Teclistamab采用了全长IgG4抗体的结构形式,其生产和开发是基于杨森生物科技公司与Genmab签订的DuoBody®技术平台许可协议。这一协议确保了两个不同靶点结合域能够正确组装并保持稳定,既满足了双特异性抗体的需求,又具备了良好的体内半衰期和药代动力学特性。
关于Duomab技术平台的详细介绍可以查阅之前发表的文章内容:技术梳理系列 | Genmab的Duomab平台]
首次缓解的中位时间:1.2个月(范围:0.2-5.5个月) sCR(严格完全缓解):22.7% CR(完全缓解):5.5% VGPR(极佳部分缓解):29.1% PR(部分缓解):4.5% 28.2% 的患者达到 ≥CR(完全缓解或更好) 中位缓解持续时间(mDOR):尚未达到
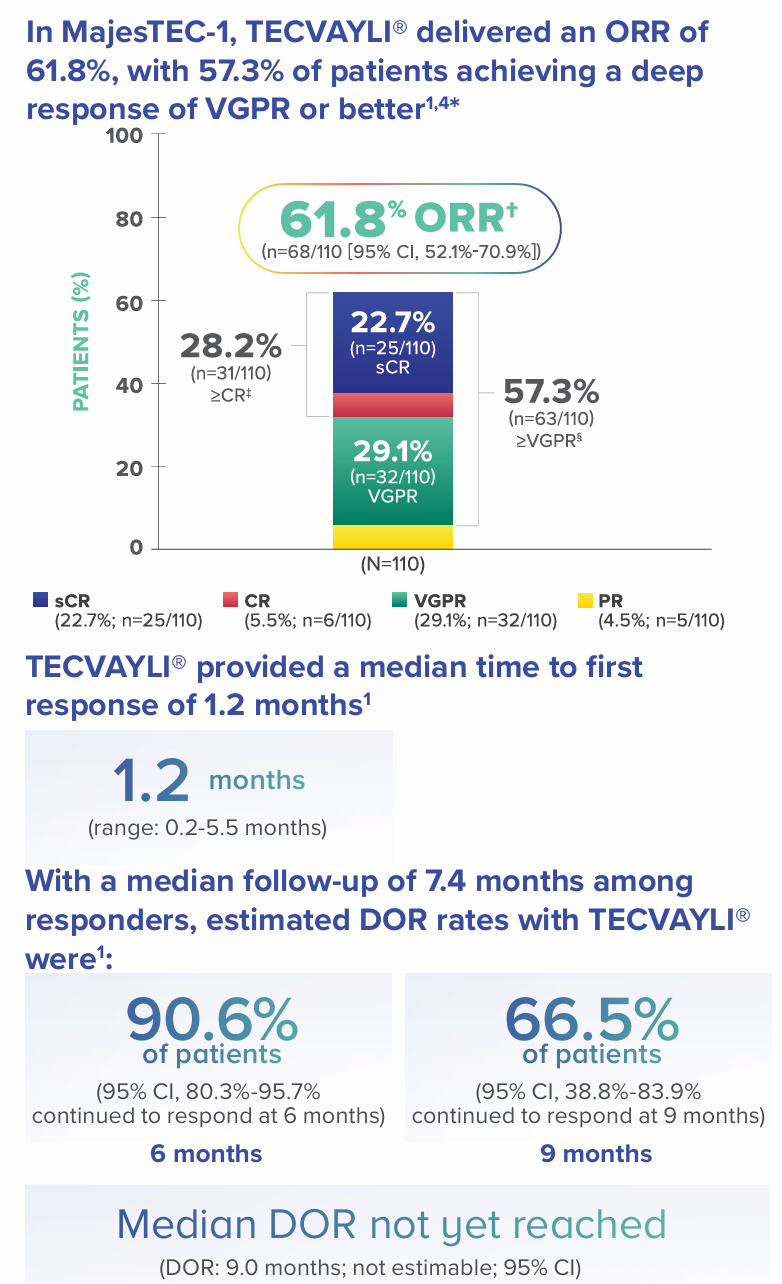
这表明Teclistamab在 患者中具有快速起效、高深度缓解率,并且缓解持续时间较长的特点。
- sCR(严格完全缓解):38.2%
CR(完全缓解):8.2% VGPR(极佳部分缓解):11.8%
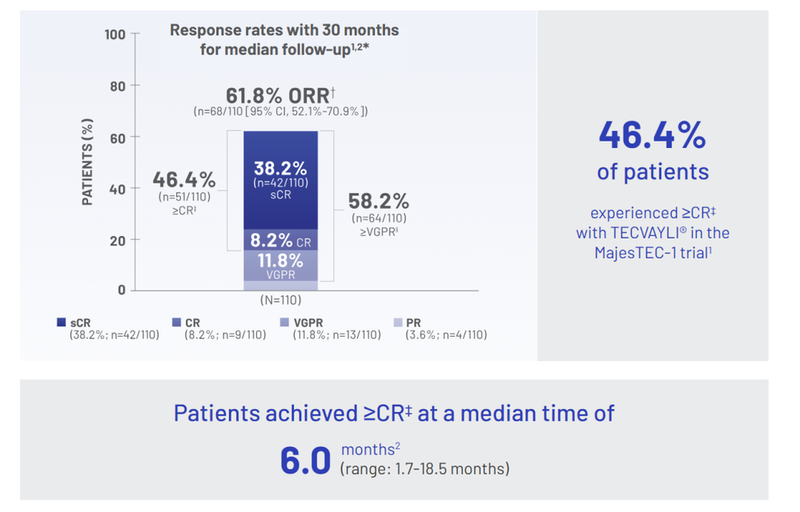
这表明,在更长时间的随访中,Teclistamab依然能维持较高的缓解率,并且深度缓解(sCR 和 CR)的患者比例较先前数据有所提升,显示出该疗法在复发/难治性多发性骨髓瘤(RRMM)患者中的持续疗效。
Teclistamab的安全性

使用Teclistamab可能会引发严重的不良反应,其中最为关键的是细胞因子释放综合征(CRS)和神经毒性。CRS是一种可能危及生命甚至导致死亡的严重反应,因此在治疗过程中,建议采用逐步加量(Step-up dosing)方案来降低CRS的发生风险。如果患者出现CRS症状,应立即暂停Teclistamab的使用,直至症状缓解,并根据CRS的严重程度来决定是否需要永久停药。
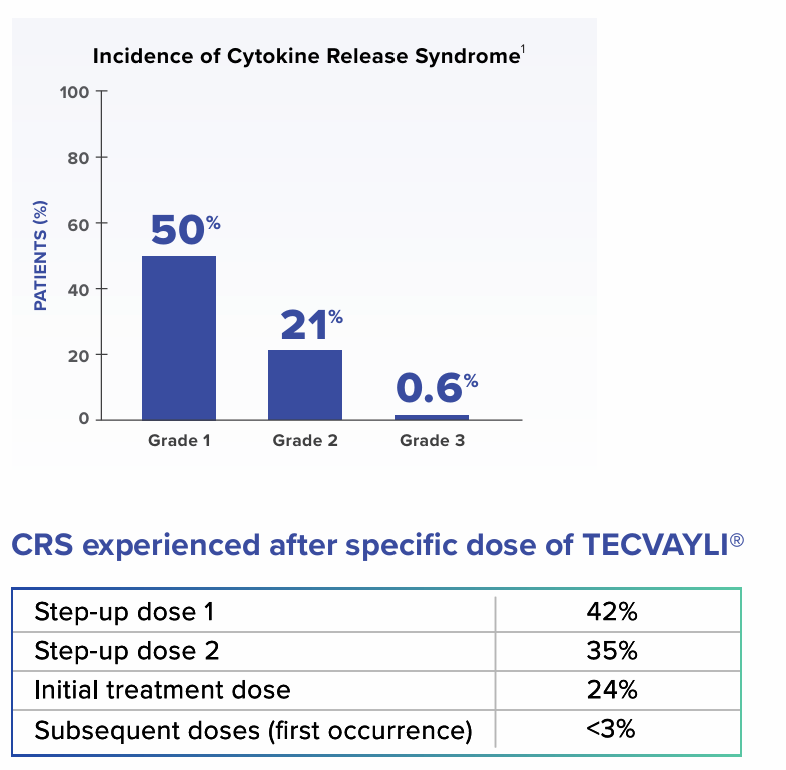
此外,Teclistamab还可能引发免疫效应细胞相关神经毒性综合征(ICANS)以及其他严重的神经毒性反应。在治疗期间,医护人员需要密切监测患者是否出现神经毒性的相关症状,如头痛、意识混乱、言语障碍等。一旦发现这些症状,应立即暂停Teclistamab的治疗,并根据患者的病情严重程度调整用药方案,以确保患者的安全和治疗的有效性。
核心专利
标题:Bcma/cd3 and gprdc5d/cd3 bispecific antibodies for use in cancer therapy
专利号:IL278654A0(申请日:2019年5月15日)
蛋白序列:包含4条关键蛋白序列


图片来源于智慧芽
总结
参考资料来源于:https://www.tecvaylihcp.com/discover-science/以及智慧芽数据库