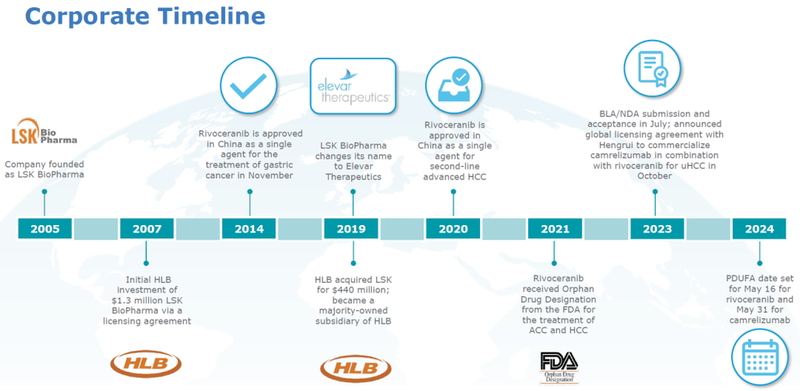
2024年5月18日,恒瑞医药发布公告,卡瑞利珠单抗+阿帕替尼联合一线治疗不可切除或转移性肝癌的上市申请收到FDA的完整回复函(CRL)。FDA表示会给予生产场地检查缺陷的完整答复进行全面评估,并且由于部分国家的旅行限制,FDA表示在审查周期内也无法全部完成该项目必须的生物学研究监测计划(BIMO)临床检查。恒瑞称将积极与FDA保持密切沟通,并尽快重新递交上市申请。

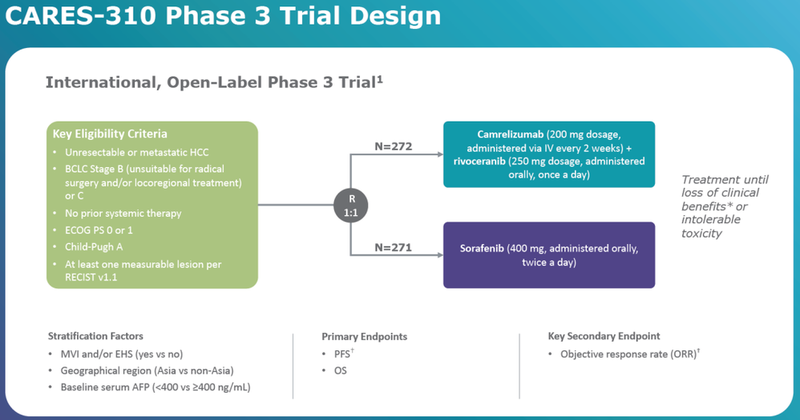
卡瑞利珠+阿帕替尼一线治疗uHCC的上市申请是依据三期临床CARES-310的数据,共入组543例,与索拉非尼头对头对照。
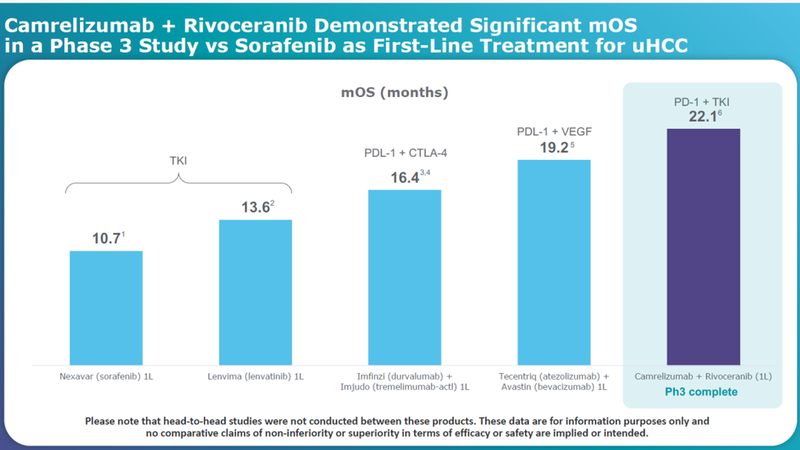
卡瑞利珠单抗+阿帕替尼治疗mOS显著超过索拉非尼。
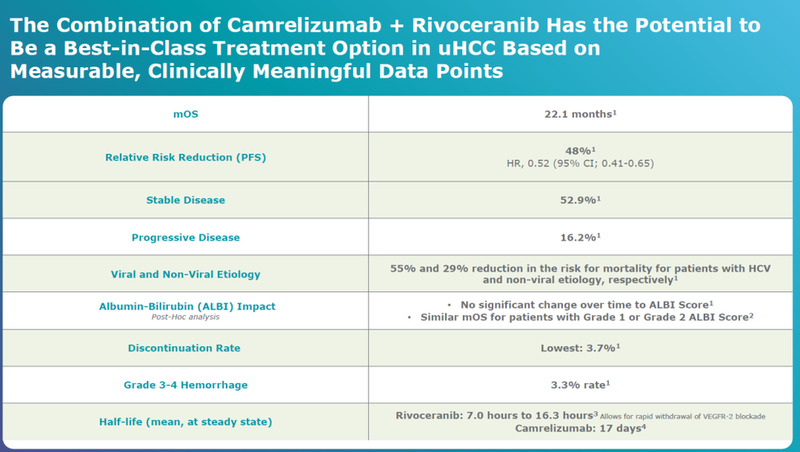
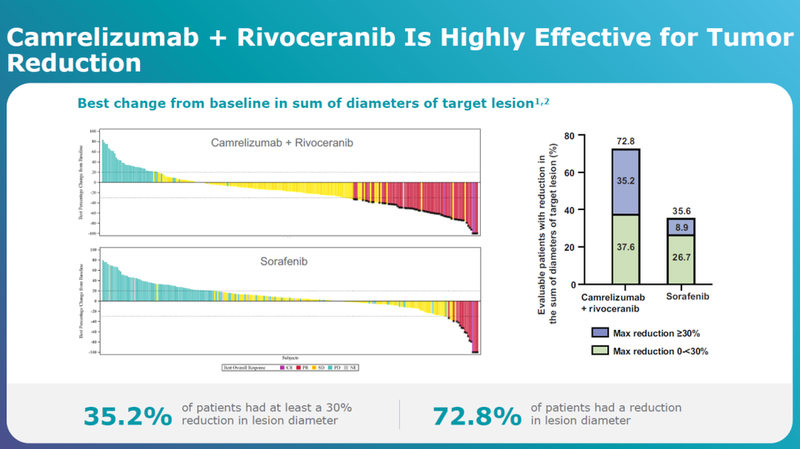
卡瑞利珠单抗+阿帕替尼联合治疗肿瘤缩小程度显著超过索拉非尼组。
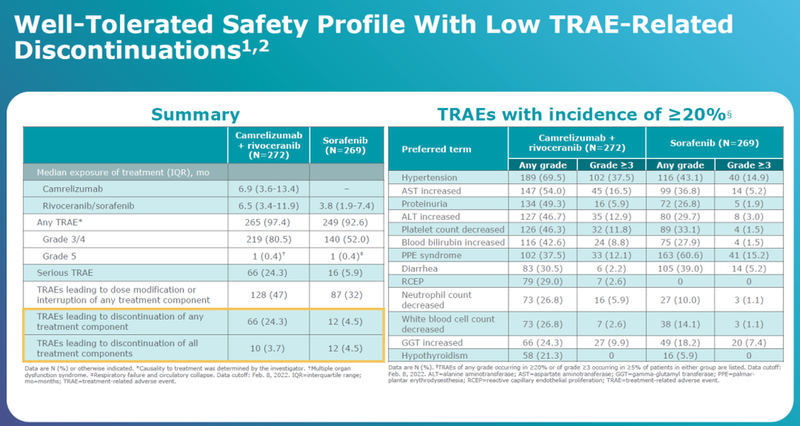
安全性数据如下。
总结
国产PD-1进军美国市场历经波折,其中旅行限制导致现场审查无法顺利进行成为一个重要原因。信达生物PD-1因为临床上标准治疗的变化等原因,被FDA拒绝批准,君实生物、百济神州的PD-1抗体则已经在美国顺利获批上市,恒瑞医药仍需要等待再次递交上市申请。