2024年10月18日,恒瑞医药在Clinicaltrials.gov网站上注册了Claudin18.2 ADC新药SHR-A1904二线治疗复发性或转移性胃癌的三期临床试验。
该三期临床计划入组524例胃癌患者,预计2027年9月初步完成。

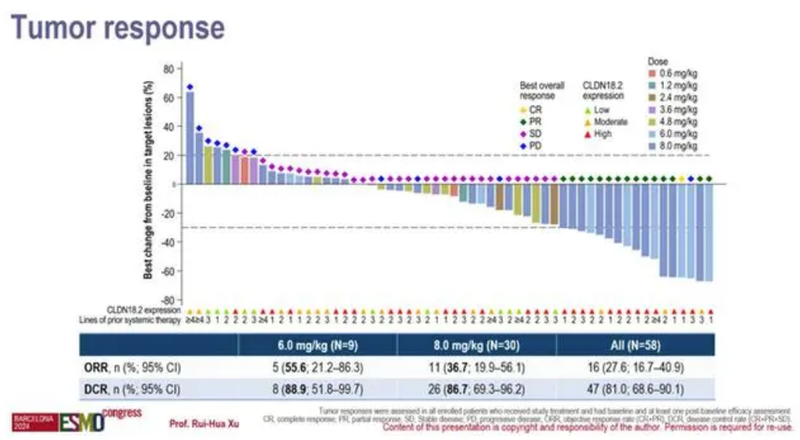
根据今年ESMO公开的一期临床数据,在6.0mg/kg剂量组,患者的ORR和DCR分别为55.6%(5/9)和88.9%(8/9),在8.0mg/kg剂量组,患者的ORR和DCR分别为36.7%(11/30)和86.7%(26/30)。
总结
昨日,FDA已经批准安斯泰来的Claudin18.2单抗上市,用于联合化疗一线治疗胃癌。国内已有创胜集团、奥赛康、明济生物的Claudin18.2抗体进入三期临床,康诺亚/乐普生物/阿斯利康的Claudin18.2 ADC进入全球三期临床,信达生物、恒瑞医药的Claudin18.2 ADC国内进入三期临床阶段。