▎Armstrong
2025年7月10日,FDA首次公开完整回复函(CRL)数据库,这一次披露了2020-2024年的202张CRL,可以让公众确切知道这些药物被拒绝批准的原因。
诺华PCSK9 siRNA疗法于2020年收到CRL,2022年获得FDA批准上市。

Inclisiran在2020年被拒绝批准的主要原因是生产问题。
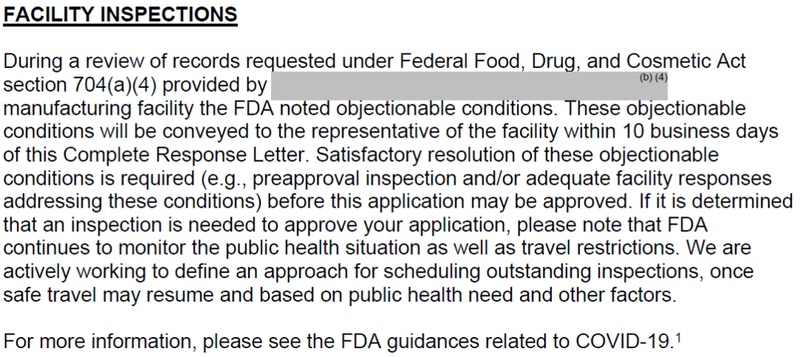
Immunomedics的Trop2 ADC新药于2019年1月收到CRL。

Trodelvy被拒绝批准的原因是生产问题。
百奥泰的贝伐珠单抗类似药于2021年11月收到CRL。

BAT1706被拒绝批准的原因是血清样本生物分析方法验证没有满足接受标准,因此PK数据不足以支持证明相似性。

康方生物PD-1抗体于2024年1月收到CRL。
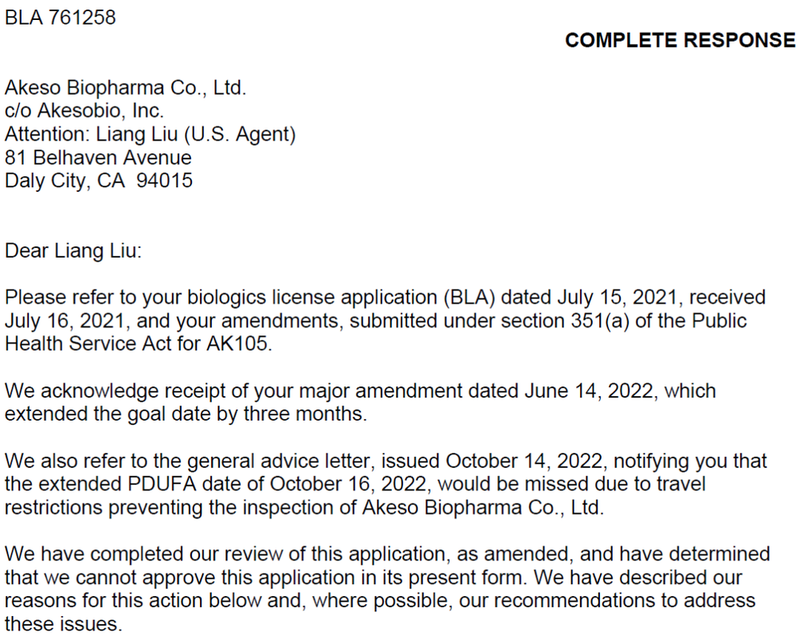
AK105(派安普利单抗)被拒绝批准的原因是临床治疗方案已经方案变化,相对于现有疗法无法证明有意义的临床优势,同时提供了潜在的注册路径,开展意向多中心随机临床试验,与可接受的标准疗法头对头,并以PFS和OS作为主要终点,同时要求入组足够代表性的美国患者。

Checkpoint Therapeutics的PD-L1抗体于2023年12月收到CRL。

Cosibelimab被拒绝批准的原因是CDMO企业三星生物的生产缺陷。

总结
此次披露的202张CRL,绝大部分是505b(2)路径的改良药和351k路径的生物类似药,同时也涉及几十款创新药。很多产品被拒绝批准的原因具有广泛的代表性,如生产问题,临床治疗格局变化问题,生物分析方法问题等。这些CRL的公开有利于行业信息公开,为后来者提供借鉴。

Armstrong技术全梳理系列
和铂医药技术全梳理; 荣昌生物技术全梳理; 再鼎医药技术全梳理; 药明生物技术全梳理; 恒瑞医药技术全梳理; 豪森药业技术全梳理; 正大天晴技术全梳理; 吉凯基因技术全梳理; 基石药业技术全梳理; 百济神州技术全梳理; 百济神州技术全梳理第2版; 信达生物技术全梳理; 信达生物技术全梳理第2版; 中山康方技术全梳理; 复宏汉霖技术全梳理; 先声药业技术全梳理; 君实生物技术全梳理; 嘉和生物技术全梳理; 志道生物技术全梳理; 道尔生物技术全梳理; 尚健生物技术全梳理; 康宁杰瑞技术全梳理; 科望医药技术全梳理; 岸迈生物技术全梳理; 礼进生物技术全梳理; 康桥资本技术全梳理; 余国良的抗体药布局; 荃信生物技术全梳理; 安源医药技术全梳理; 三生国健技术全梳理; 仁会生物技术全梳理; 乐普生物技术全梳理; 同润生物技术全梳理; 宜明昂科技术全梳理; 派格生物技术全梳理; 迈威生物技术全梳理; Momenta技术全梳理; NGM技术全梳理; 普米斯生物技术全梳理; 普米斯生物技术全梳理2.0; 三叶草生物技术全梳理; 泽璟制药抗体药全梳理; 恒瑞医药抗体药全梳理; 齐鲁制药抗体药全梳理; 石药集团抗体药全梳理; 豪森药业抗体药全梳理; 华海药业抗体药全梳理; 科伦药业抗体药全梳理; 百奥泰技术全梳理; 凡恩世技术全梳理。