2024年5月21日,信达生物IGF-1R抗体替妥尤单抗上市申请获得NMPA受理,用于治疗甲状腺眼病。该产品组分与Horizon(Amgen)Tepezza相同,采用新剂型,按2.1类途径申报。
替妥尤单抗于2021年12月首次申报IND获受理,到如今上市申请获受理,只花了2年半的时间,相比Tepezza于2020年1月在美国获批上市,也仅仅只过去了不到4年半。
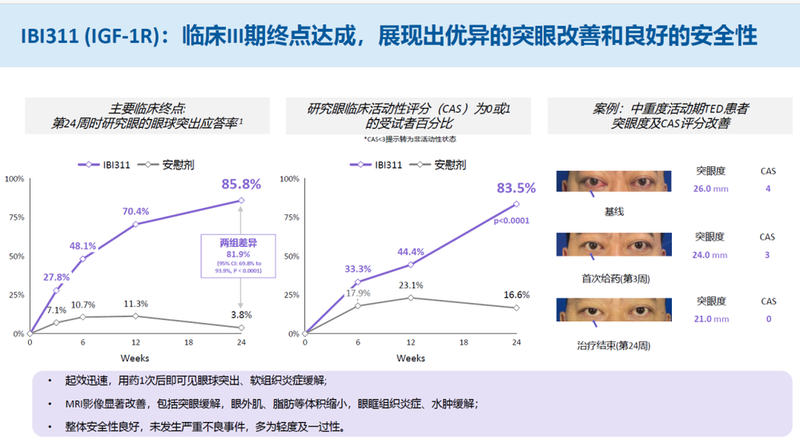
替妥尤单抗三期临床中表现出优异的疗效与安全性。
Teprotumumab最初由Genmab在2004年研发,同年授权给罗氏,主要探索癌症领域,罗氏终止研发后在2011年又授权给RVDC,RVDC则将开发方向转向甲状腺眼病。RVDC在2017年被Horizon Therapeutics收购,Horizon则在去年被安进以280亿美元收购。由于临床探索历经波折,Teprotumumab的核心化合物专利将在2024年到期,其他相关专利进一步拓宽护城河,如美国的专利可保护至2032年。
Teprotumumab在中国的主要专利为核心化合物专利,申请日为2004年7月9日,保护期至2024年7月9日。

总结
Tepezza年销售额高达20亿美元,为眼科领域治疗眼底血管增生性疾病AMD等的VEGF之后,又一个重要靶点。由于Teprotumumab临床探索时间长,上市时化合物专利已经快到期,在欧美可以通过其他相关专利来进一步延长保护期,在中国则主要依靠化合物专利。由于Tepezza暂未进入中国,信达IBI311将成为国内首款IGF-1R抗体。