偏头痛(MH)是一种慢性原发性神经血管性头痛,特点为反复发作的头痛,并常伴有恶心、呕吐、畏光和恐声等症状。三叉神经血管系统的激活、硬脑膜神经源性炎症(DNI)、敏化、皮层和皮下神经网络的失调、神经肽的释放、能量代谢异常以及氧化应激反应被认为是MH发作起始和传播的关键机制。目前,临床上用于治疗MH的主要药物包括曲普坦类和阿片类药物,这些药物虽在缓解头痛及其伴随症状方面具有一定的效果。然而,长期使用这些药物可能导致疗效减退及不良反应的发生。
川芎清脑颗粒(CQG),具有祛风除湿、活血化瘀、止痛的功效,适用于治疗高血压头痛、MH等疾病。药理学研究显示,CQG能够降低血液黏度,抑制血管收缩,减少血小板聚集率,改善血液循环障碍,保护脑组织细胞免受氧化损伤,从而有效治疗MH。然而,目前关于CQG的研究主要集中在临床试验阶段,其治疗MH的潜在机制尚未完全明了。
近日,一篇名为“Chuanxiong Qingnao Granules (CQG) alleviates nitroglycerin-induced migraine-like pain in rats by glycerophospholipid metabolism and PI3K/ Akt signaling pathway”的文章探索了CQG在硝酸甘油(NTG)诱导的MH损伤中的治疗机制。

图1 论文首页
CQG改善了NTG诱导大鼠的行为变化、药理指标和病理变化
注射NTG后,NTG组大鼠耳部发红的持续时间(以分钟计)及抓耳次数明显高于对照组(Con组)。相对而言,CQG低剂量组(CQG-L)与CQG高剂量组(CQG-H)的耳部发红持续时间及抓耳次数显著减少(图2B)。同样地,NTG组中5-HT、ET-1、CGRP1和TNF-α的表达水平显著高于Con组(P<0.05),而(氟桂利嗪)Flu组和CQG组中这些生物标志物的表达水平均有不同程度的显著降低(图2C)。HE染色结果显示,Con组的神经元细胞排列有序,边界清晰,未见细胞破坏现象。而NTG组则表现出炎性细胞浸润、细胞肿胀及紊乱,以及中脑区域的广泛空泡化(图2D)。与NTG组相比,CQG组(包括CQG-L和CQG-H)显示出炎性细胞浸润减少、纤维化减轻以及神经元细胞间隙中的空泡减少,这表明CQG可能逆转MH过程中出现的组织学改变,揭示了CQG对NTG诱导的MH变化具有显著的抗MH效应。

图2 CQG对NTG处理大鼠的实验设计、行为分析和组织病理学变化
通过代谢组学分析鉴定参与CQG抗偏头痛作用的代谢物
为评估代谢组的变动情况,该研究对Con组、NTG组和CQG组的数据集执行了主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)。PCA分析揭示了在正负离子模式下,Con组、NTG组和CQG组的代谢谱呈现显著的分离趋势,累计R²X值分别为0.518和0.502(图3A)。PLS-DA分析结果表明,在正离子模式和负离子模式下,三组之间的代谢谱具有显著的区分度,累计R²X值分别为0.865和0.878。进一步采用正交偏最小二乘判别分析(OPLS-DA)对Con组与NTG组之间、NTG组与CQG组之间的代谢谱进行了区分(图3B)。结果显示,代谢谱明显分离,NTG与Con的R²Y(cum)和Q²(cum)值分别为0.944和0.475(正离子模式)与0.938和0.434(负离子模式)。在正离子模式下,CQG和NTG的值分别为0.968和0.433,在负离子模式下,分别为0.962和0.339。通过置换检验证实了OPLS-DA模型在NTG与Con和CQG与NTG组之间比较的稳健性,每个测试包括100次迭代,表明模型中不存在过拟合现象。
根据DM的筛查标准,NTG组与Con组共发现32种DM,CQG组与NTG组共发现50种DM。图3C展示了DM在对照组、NTG组和CQG组中的分布热图。图3D中的维恩图揭示,NTG与Con和CQG与NTG组之间共享五种DM:DL-蛋氨酸亚砜、十二烷酸、苯乙酰-L-谷氨酰胺、pindolol和黄嘌呤。进一步研究发现,与NTG相比,CQG处理后十二烷酸、苯乙酰-L-谷氨酰胺和pindolol的相对峰面积发生了逆转,表明这些代谢物是CQG治疗MH的关键DM(图3E)。此外,代谢组学途径分析显示,NTG组与Con组的DM主要富集于脂肪酸生物合成、咖啡因代谢、精氨酸和脯氨酸代谢、组氨酸代谢、甘油磷脂代谢和嘌呤代谢等途径。同样,CQG组与NTG组中鉴定的DM富集途径,包括乙醛酸和二羧酸代谢、嘧啶代谢、组氨酸代谢和嘌呤代谢(图3F-G)。

图3 Con组、NTG组及CQG组的代谢特征
整合转录组学分析和代谢组学分析
经过对转录组学与代谢组学分析数据的综合分析,研究确认了甘油磷脂代谢在MH中的关键作用。如图4A-B所展示,通过区分NTG组与Con组的差异表达基因(DEG),例如PLA2G1B,以及多种代谢物,揭示了MH进展过程中甘油磷脂代谢途径的改变。在比较CQG组与NTG组时,DEG和代谢产物如AGPD1、ALDOB、LIPG、LPL、DGKK,以及甘油3-磷酸和1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸乙醇胺,表明CQG可能具有调节该途径的潜力。
具体而言,CQG的给药导致某些代谢物浓度的提升,这些代谢物在MH大鼠中呈现下降趋势(图4C)。另有研究指出,甘油磷脂代谢途径中的DEGs与PI3K/Akt信号通路中的靶点存在关联。综合上述证据,可以得出结论,PI3K/Akt通路的差异表达基因与随后的甘油磷脂代谢之间存在密切的联系。

图4 转录组学与代谢组学分析图
CQG通过抑制PI3K/Akt信号通路,降低了IL-17A、IL-13、CCR3的表达,并抑制了神经炎症相关细胞因子的表达
为了深入探究CQG的抗炎特性,研究采用了细胞因子芯片技术,对包括G-CSF、GM-CSF、GRO/KC、IFN-γ、IL-1α、IL-1β、IL-2、IL-4、IL-5、IL-6、IL-7、IL-10、IL-12、IL-18、M-CSF、MCP-1、MIP-1α、MIP-3α、RANTES和VEGF在内的多种炎性细胞因子水平进行了评估。结果显示,在NTG组中,这些细胞因子的水平显著升高,然而在CQG处理后,它们的水平出现了不同程度的降低(图5A)。在与甘油磷脂代谢相关的信号通路中,鉴于PI3K/Akt通路与炎症、神经退行性疾病以及多种生理功能的紧密联系,该通路被认为在MH的发生和发展中扮演了关键角色。特别值得注意的是,MH组体内PI3K、Akt及其磷酸化蛋白(p-PI3K和p-Akt)的总蛋白和磷酸化水平显著升高。然而,在CQG干预后,PI3K/Akt通路的激活受到了显著抑制,这表现为上述磷酸化蛋白水平与MH组相比呈现剂量依赖性的下降(图5B)。
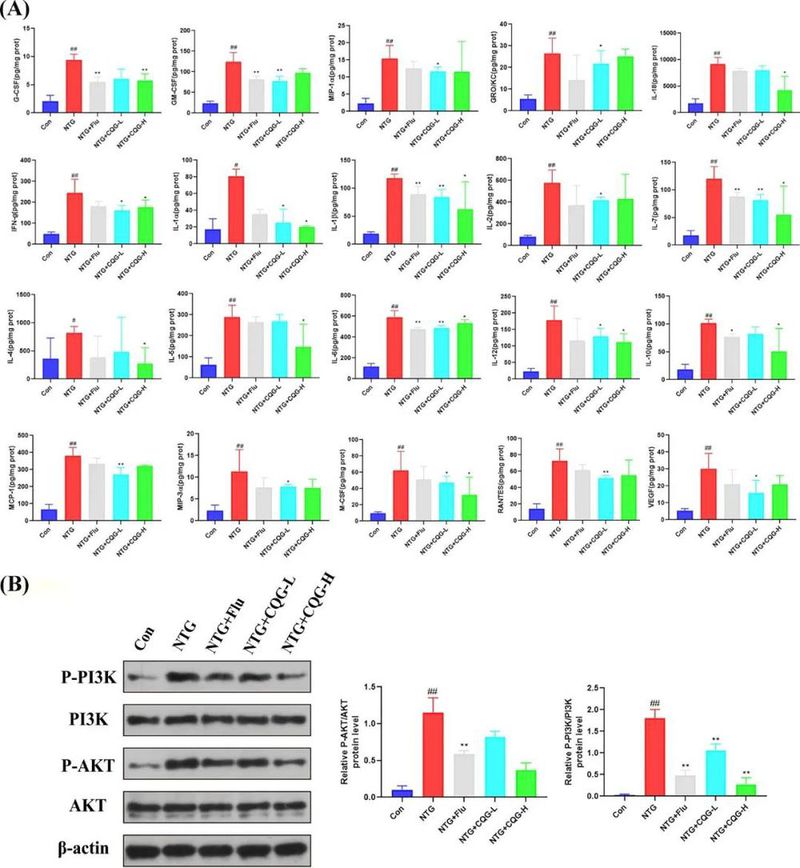
图5 CQG抑制了多种细胞因子和PI3K/Akt信号通路