作者|小鱼
* 傅新元博士对本文亦有贡献
之前的文章(“TL1A靶点:两全其美的自免炎症通路放大器能否通过成药性考验?”)讲到,通过频繁的交易并购,临床阶段针对TL1A靶点的管线已被MNC垄断,有默沙东、罗氏、赛诺菲、辉瑞。
虽然STAT6靶点开发进度落后于TL1A靶点,尚未有可读的临床数据,成药不确定性更强,但也同TL1A靶点一样,成为MNC硝烟四起的自免战场的必争险要。STAT6赛道较为活跃的MNC有吉利德、强生、赛诺菲。
毕竟沙利文预测2030年全球自免市场有望达到1760亿美元。参考Dupixent,目前STAT6药物适应症开发方向为免疫炎症性疾病,主要为慢性阻塞性肺病(COPD)、哮喘、特应性皮炎(AD)。市场容量可观:①到2034年,全球COPD市场预计将达到330.3亿美元。②到2034年,全球哮喘市场预计将达到359.3亿美元。③到2034年,全球特应性皮炎市场预计将达到314.4亿美元。MNC早早强势布局无可厚非。本文将介绍STAT6靶点的作用机制、管线交易,总结STAT6靶点的优势特点。
要点速览:
●STAT6抑制剂/降解剂作用机制类似于赛诺菲/再生元的上市药物达必妥(Dupilumab,一款靶向IL-4Rα的单抗,海外商品名Dupixent)。鉴于Dupilumab作用机制已得到证实,STAT6成药性风险略有降低;
01
STAT6是JAK/STAT信号通路上的关键分子,
具有信号转导和转录激活的双重功能
30多年前,Janus激酶(JAK)信号转导和转录激活因子(STAT)通路被发现。该信号通路被认为是细胞功能中的中心通讯节点之一。
在JAK/STAT信号通路中已鉴定出50多种细胞因子和生长因子,例如激素、干扰素(IFN)、白细胞介素(IL)和集落刺激因子。
JAK/STAT介导的下游事件各不相同,包括造血、免疫适应性、组织修复、炎症、细胞凋亡和脂肪生成。
JAK与细胞因子受体非共价结合,介导受体的酪氨酸磷酸化,并募集一种或多种STAT蛋白。酪氨酸磷酸化的STAT二聚化,然后通过核膜转运到细胞核中以调节特定基因。

1.1 STAT6信号通路具有一定的独立性
尽管STAT可以被部分重叠的细胞因子激活,但不同的STAT具有非冗余的生物学效应。其中STAT6相对于其他家族成员来说相对独立,目前没有发现和其他STAT的合作和对抗。作用机制如下:
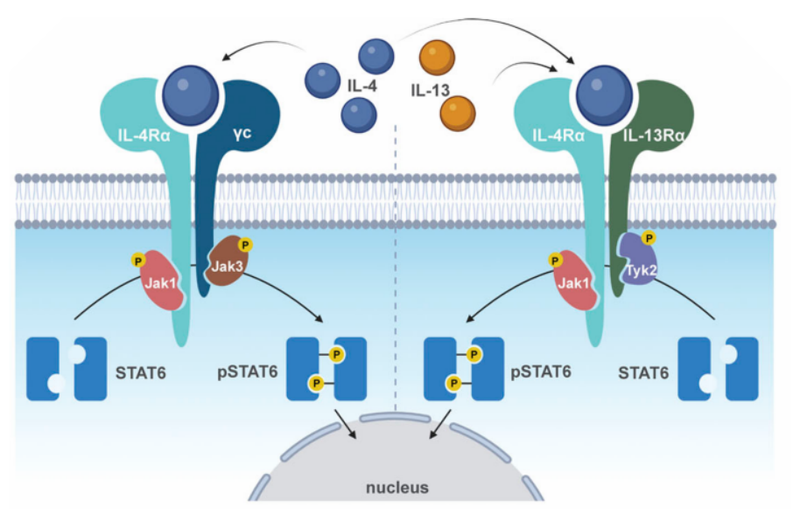
①信号启动:细胞因子IL-4和IL-13与细胞表面的相应受体结合,从而启动信号传导过程。
②JAK激酶活化:受体被激活后。与之偶联的JAK激酶被招募并磷酸化,进而激活JAK激酶活性。
③STAT6磷酸化:活化的JAK激酶使STAT6在保守的酪氨酸(Y)-641位点发生磷酸化。
④二聚体形成:磷酸化后的STAT6发生聚合,形成同源或异源二聚体。
⑤核内结合和转录:STAT6二聚体进入细胞核,与靶基因启动子序列的特定位点结合,促进相关基因的转录,从而调控细胞的生长、分化、免疫应答等多种生理过程。
1.2 STAT6蛋白结构
STAT6基因编码850个氨基酸。STAT6蛋白具有N末端结构域(ND)、卷曲螺旋、DNA结合、接头、SH2和反式激活结构域(AD),其中641位的酪氨酸磷酸化位点表示着STAT6 的激活。研究指出S407可能是病毒激活STAT6的关键磷酸化位点。在某些细胞和组织中,STAT6的剪接变体很明显。STAT6b在氨基末端有一个缺失,并且STAT6c的SH2结构域的一部分缺失。

1.3 STAT6蛋白生物学功能
STAT6主要参与IL-4和IL-13信号的转导。IL-4诱导STAT6的激活,这是Th2细胞分化和免疫球蛋白同种型转换的关键。此外,IL-4诱导的T细胞中STAT6的激活还可以抑制整合素粘附分子家族成员VAL-4的表达,从而抑制CD8+ T细胞浸润到肿瘤中。STAT6可促进B细胞的增殖和成熟,介导MHC-II和IgE的表达,在肥大细胞活化中发挥重要作用。与其他STAT相比,STAT6可以被病毒激活,而无需依赖JAK。STAT6还诱导免疫细胞中归巢相关基因的表达,在先天免疫中发挥重要作用。例如,STAT6 二聚体诱导CCL2的表达并募集T细胞、巨噬细胞和单核细胞;CCL26诱导嗜酸性粒细胞/碱性粒细胞和NK细胞归巢;CCR6募集树突状细胞、B 细胞、T细胞等。
02
STAT6靶点最大的优势
来源于上市药物Dupixent的成功
2.1 STAT6靶点可能推动类似Dupilumab的价值
STAT6药物可能具有类似Dupilumab的作用机制。Dupilumab(商品名Dupixent)是一种全人源单克隆抗体,可抑制IL-4/13通路的信号传导,但不是免疫抑制剂。
Dupilumab在3期试验中显示出显著的临床益处和2型炎症的减少,证实IL-4和IL-13是2型炎症的关键和核心驱动因素,在多种相关且经常发生的炎症中发挥着重要作用。

从图4中可以看到STAT6是Dupilumab发挥作用的必经之路。研究表明,STAT6是IL-4/IL-13信号通路必需转录因子和TH2炎症核心驱动因素。STAT6缺陷小鼠无法产生2型免疫反应,寄生虫消除受损,过敏性疾病减少。种系STAT6 GOF突变与嗜酸性粒细胞增多症、难治性过敏性疾病有关。全基因组关联分析表明,与STAT6关联的疾病包括过敏、哮喘和嗜酸性粒细胞增多症。
由此,可以推测抑制或者降解STAT6或许可以起到抑制IL-4Rα类似的作用机制。在开发STAT6靶点的征程上,有望产生类似“Dupixent”的重磅药物。

Dupixent于2017年上市,目前已批准用于特应性皮炎、哮喘、慢性鼻窦炎伴鼻息肉病(CRSwNP)、嗜酸性粒细胞性食管炎(EoE)和结节性痒疹。2024年销售额达到130.72亿欧元,成为名副其实的超级重磅药物。
2.2 靶向性强
STAT6能选择性介导IL-4和IL-13的下游信号,并不被其他细胞因子和生长因子利用,理论上可以实现更精准的治疗,减少对其他无关信号通路的干扰,降低副作用。
2.3 治疗潜力大
借助赛诺菲对Dupilumab适应症的规划,可以推断STAT6在2型炎症性疾病如特应性皮炎、哮喘、慢性阻塞性肺病等,以及一些淋巴瘤等疾病的病理生理过程中起着关键作用,有望为这些疾病的治疗提供新的有效手段。

2.4 口服剂型前景好
目前开发的STAT6抑制剂多为口服剂型,若研发成功,相比注射剂等其他剂型,将为患者提供更便捷的治疗方案,提高患者的治疗依从性。
03
研发管线交易频繁
Kymera KT-621表现突出
3.1 MNC频频出手,赛诺菲尤为急切
面对庞大的免疫炎症性疾病市场,STAT6抑制剂领域竞争日益激烈,吸引了众多MNC的兴趣,交易管线都处于临床前阶段且交易金额大多超过10亿美元,可见STAT6靶点在MNC心中的地位。特别是赛诺菲在Dupixent不断扩大的适应症和狂飙的年销售额中尝到甜头,因此联合两家生物公司不遗余力地开发STAT6。鉴于赛诺菲对IL4/13通路的了解程度,另一种角度来说,也部分释放了STAT6靶点的成药性风险。
①吉利德首次进入STAT6抑制剂领域
2025年1月12日,吉利德科学(Gilead Sciences)宣布与Leo Pharma达成一项总价值达17亿美元的合作协议,获得后者口服STAT6抑制剂项目的全球独家权益。
②强生希望通过STAT6布局特应性皮炎和哮喘领域
2024年12月26日,强生宣布引进日本药企Kaken Pharmaceutical的临床前阶段STAT6抑制剂KP-723的日本外全球权益,强生支付3000万美元预付款、12.175亿美元里程碑金额,以及个位数至低双位数比例的销售分成。
③赛诺菲通过多方合作,对STAT6药物势在必得
赛诺菲在该领域尤为活跃,与Nurix Therapeutics和Recludix Pharma达成了STAT6相关项目的合作协议。2024年4月,赛诺菲与Nurix的合作延长,聚焦于开发一种口服STAT6降解剂,并计划在延长的第一年内选定候选药物。2023年7月,赛诺菲与Recludix达成协议,开发口服小分子STAT6抑制剂,该协议包括1.25亿美元的近期付款和超过12亿美元的潜在里程碑付款。
3.2 候选药物中KT-621进展又快又稳
据不完全统计,目前在研的STAT6药物有十余款。
表1 研发管线

其中Kymera开发的强效、选择性、口服给药的STAT6 PROTAC产品KT-621开发进度领先:
①快:2024年10月开展1期临床,预计2025年6月完成
进展最快的KT-621正在进行健康成人受试者口服KT-621的首次人体研究,是一项随机、安慰剂对照、首次人体单次和多次递增剂量研究的1期研究(NCT06673667),旨在评估健康成人受试者口服KT-621的安全性、耐受性、药代动力学和药效学。
该1期临床试验处于健康志愿者招募阶段,共需要120名健康志愿者,主要研究指标为不良事件发生率。临床数据预计2025年上半年公布。
表2 1期临床试验设计方案

②稳:Kymera做了很多KT-621临床前研究工作
一是Kymera利用蛋白降解剂开发技术,解决了STAT6难以靶向的问题。STAT6 通过蛋白质-蛋白质和蛋白质-DNA相互作用发挥作用。因此,使用传统小分子抑制STAT6一直具有挑战性。然而,STAT6蛋白非常适合靶向蛋白质降解方法,可以采用PROTAC结合STAT6以驱动降解。Kymera前研究结果表明KT-621可以在体内稳定地降解STAT6蛋白,且选择性极好。

图7 靶向STAT6降解示意图

图8 KT - 621在所有经评估的与疾病相关的人类细胞类型中均显示出稳定的降解效果

图9 100倍的DC90下,KT-621在人PBMC蛋白组中具有极好的STAT6降解选择性,未观察到其他STAT的降解

图10 KT-621具有极好的STAT6通路选择性,未观察到对任何其他STAT的影响
二是Kymera在临床前测试中已经通过靶向IL-4/IL-3通路证明了类似Dupilumab的作用机制。在2024年5月召开的美国皮肤病学会上,Kymera报告了一项临床前研究工作,题目为“强效和选择性口服STAT6降解剂可抑制人体细胞中的IL-4和IL-13功能,并阻断特应性皮炎小鼠模型中的TH2炎症”,强调人类遗传学和dupilumab的临床通路验证都支持靶向STAT6。

图11 KT-621在关键的人TH2细胞分析中完全阻断IL-4/13功能,皮摩尔IC50低于IL-4Rα单克隆抗体dupilumab。

图12 KT-621导致STAT6降解,在MC903特应性皮炎模型中强烈抑制体内TH2炎症的生物标志物,可与IL-4Rα单克隆抗体dupilumab相媲美。
写在最后
凭借靶向STAT6蛋白逐渐成熟,STAT6是历史上未被证实的IL-4/IL-13信号通路必需转录因子,也是TH2炎症的核心驱动因素,再者STAT6基本是免疫系统作用,患者对靶向STAT6的药物耐受性会更好,因此理论上STAT6靶点比上游JAK等靶点和STAT3靶点理论上安全性会好,相信布局STAT6研发管线的企业可以从中受益。
当然靶向STAT6药物开发风险仍然存在。尽管临床前数据表明药物通过IL-4/IL-13通路具有类似Dupilumab的靶向性,但是还需要进行临床验证,另外迄今还没有protac成药,Kymera的KT-261成药存在较大的不确定性,不能保证能够复制Dupilumab的成功,因此需要谨慎布局STAT6靶点。
公众号已建立“小药说药专业交流群”微信行业交流群以及读者交流群,扫描下方小编二维码加入,入行业群请主动告知姓名、工作单位和职务。