行业政策
No.1 / 数据保护终出台!新药最长可获得6年保护期
2025年3月19日,国家药监局公开征求《药品试验数据保护实施办法(试行,征求意见稿)》和《药品试验数据保护工作程序(征求意见稿)》意见,于2025年5月18日截止。为鼓励药品创新,满足公众用药需求,根据《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》《药品注册管理办法》等有关规定制定《药品试验数据保护实施办法(试行)》。
数据保护是指,含有新型化学成份的药品以及符合条件的其他药品获批上市时,国家药监局对申请人提交的自行取得且未披露的试验数据和其他数据实施保护,给予最长不超过6年的数据保护期。在数据保护期内,其他申请人未经药品上市许可持有人(以下简称持有人)同意,依赖前款数据申请药品上市许可或者补充申请的,国家药监局不予许可;其他申请人自行取得数据的除外。在数据保护期内,其他申请人提交自行取得数据申报药品注册申请的,符合条件的应当予以批准,不再给与数据保护期,但该数据不得被后续其他申请人依赖。
受保护的数据主要是指未披露的试验数据和其他数据,即在境内首次用于药品上市许可申请中未公开的完整申报资料中的试验数据。药品获得批准后根据药品监管部门要求完成后续研究工作时获得的试验数据,不再给予新的数据保护。
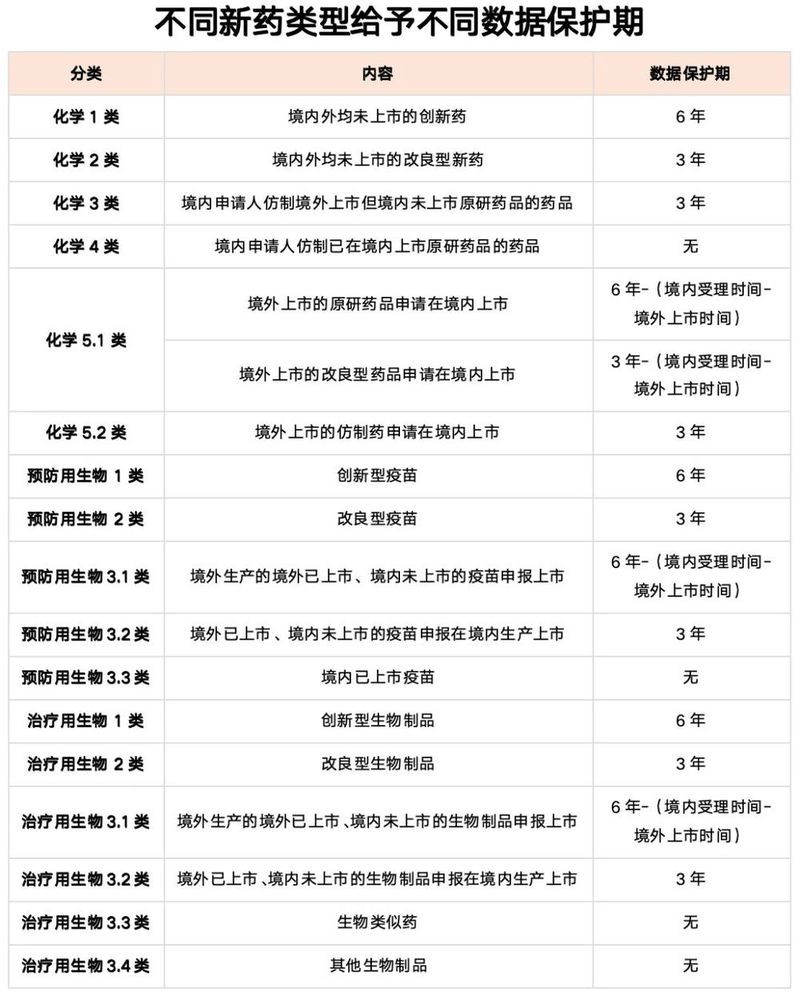
药品获得数据保护后,其他申请人在数据保护期届满前1年内可以提交依赖该受保护数据的药品上市申请和补充申请,药审中心完成技术审评后中止审评计时,数据保护期届满后批准相关药品上市。申请人在提交药品上市申请和补充申请时声称数据为自行取得,但是在技术审评过程中发现该申请依赖了其他申请人受保护数据的,不予许可该申请。
国家药品监督管理局药品审评中心(以下简称药审中心)在国家药监局的指导下,负责数据保护的具体实施工作。
在受理化学药品和生物制品上市许可申请时,同步审查药品注册申请人(申请人)提交的数据保护申请。审评过程中判断是否给予数据保护,明确数据保护的范围和期限。
->点击阅读原文,解锁完整双语新闻
全球医疗情报领导者
解锁隐藏在数据中的商业潜力
关于 G B I
”
自从2002年成立以来,GBI始终以技术为驱动,为药企、器械及行业相关服务商提供贯穿生命周期的全球药品市场竞争数据、全球行业资讯、HCPs洞察、全国医疗器械数据等商业信息与洞察,助力企业在进行战略布局和决策时,脱颖而出。历经20余年的深耕细作GBI已成为95%以上跨国药企、国内头部药企、咨询与投资机构等医疗圈灯塔用户值得信赖的长期合作伙伴。
联系我们
投稿 | 发稿 | 媒体合作
▶ xujingou@baidu.com
数据库 | 咨询服务 | 资讯追踪
▶ 点击左下“阅读原文”完成表单填写

点击阅读原文,解锁完整双语新闻
