
超70%靶标成功激活
使用AI蛋白质模型RFdiffusion和ProteinMPNN,该团队先设计了在MHC分子上拱起并与疾病相关肽进行高度特异性接触的小蛋白质。
随后他们在11种不同的肽-MHC 靶标上测试了这种新的粘合剂设计方法,包括来自 HIV 的片段和与癌症相关的突变肽。
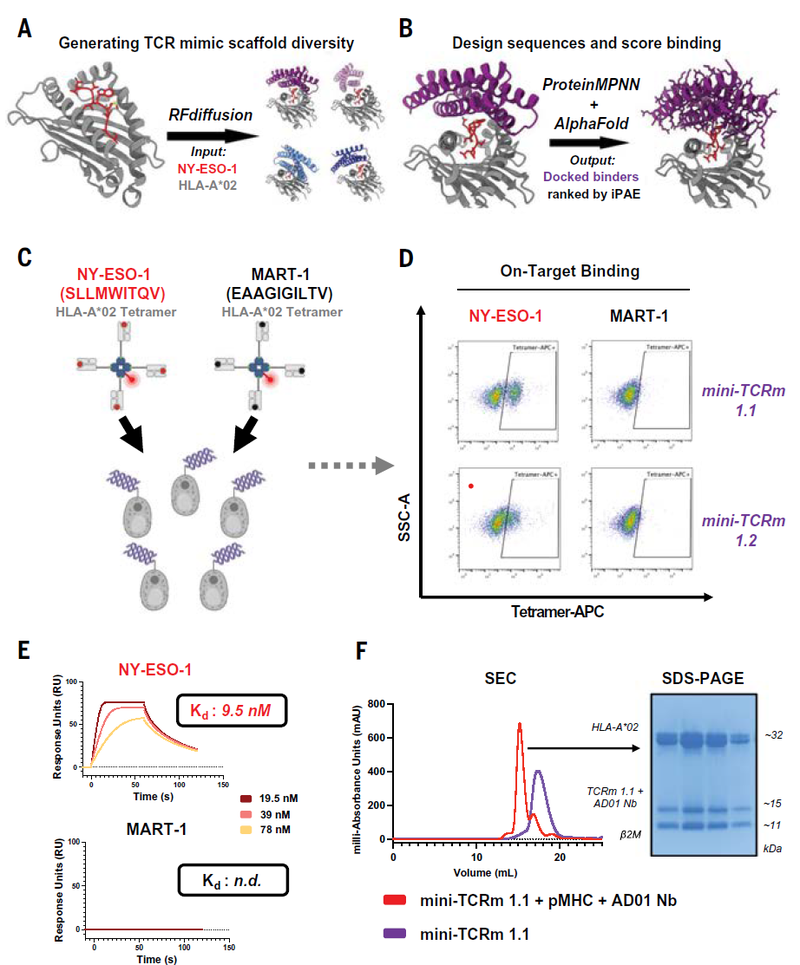
当设计的蛋白质被掺入嵌合抗原受体(CAR)中时,其中8个靶标实现了免疫细胞激活,超过总数的70%。
其中2种设计的蛋白质还被证明可以激活对在实验室测试中显示疾病标志物的人类细胞的靶向杀伤。
一个突出的靶点是肿瘤抗原PRAME,它在许多癌症中含量丰富。
由于 PRAME-MHC 不存在高分辨率结构,该团队使用 AlphaFold3 对其进行预测,然后使用模拟的目标结构创建功能性粘合剂。
配备这些新型 PRAME 靶向蛋白的 CAR-T 细胞选择性地破坏携带 PRAME 标记的细胞,而不会伤害类似的健康细胞。
设计过程也被证明具有很强的适应性。从一种成功的人工智能生成的粘合剂开始,该团队用了不到一周的时间就创建了能够与不同肿瘤和病毒肽靶标结合的新版本。
中国博后一作 将成立新公司
该成果具有很突出的商业价值。
与通常依赖于筛选大量实验文库的传统药物发现方法不同,使用AI从头设计的这些蛋白质开发成本相对低廉。
并且因为方法是完全计算的,所以它可以应用于广泛的疾病标志物,包括那些与目前无法治愈的疾病相关的疾病标志物,同时为更加个性化的药物打开了大门。
在相关报道中论文第一作者兼共同通讯作者刘炳旭博士表示:
“我们已经展示了蛋白质设计的进步如何使个性化癌症治疗成为可能,我们打算创办一家公司,将这些结果转化为造福患者的真正疗法。”
刘炳旭博士2016 年本科毕业于浙江大学,2023 年博士毕业于麻省理工学院,2023 年至今在 David Baker 实验室进行博士后研究。

据悉,华盛顿大学已就这项研究中开发的蛋白质申请了临时专利,这些蛋白质尚未在动物或人类中进行测试。
据智药局统计,David Baker的成果已孵化了23家生物科技公司(其中一半左右是在近五年创立),总共筹集了超过15亿美元(约合人民币106亿元)的资金。
可以预见,人工智能正为肿瘤免疫治疗带来颠覆性变革,预示着一个更高效、低成本且高度个性化的抗癌新纪元。
相信随着这项技术从实验室加速走向商业化,未来有望为全球癌症患者带来革命性的精准治疗方案。