近日,Nature期刊发表了一篇很有意思的文章,想和大家一起分享一下。
这篇文献名为《Prohormone cleavage prediction uncovers a non-incretin anti-obesity peptide》,主要讲了研究人员新发现一种名为BRP的新型抗肥胖肽的研究。
那么BRP是如何被发现的呢?
研究人员通过干湿实验结合的研究方法,一步一步向BRP走近~
首先,研究人员开展了一系列的干实验:
1. Peptide Predictor工具开发:这是研究人员开发的一种基于PCSK前体激素加工的系统计算-功能方法。该工具通过正则表达式(RegEx)匹配蛋白质序列中的特定文本模式,识别出可能被PCSK酶识别的切割位点,从而预测可能产生的肽片段。[简单来说就是给计算机一个指令,计算机给你一个反馈]。
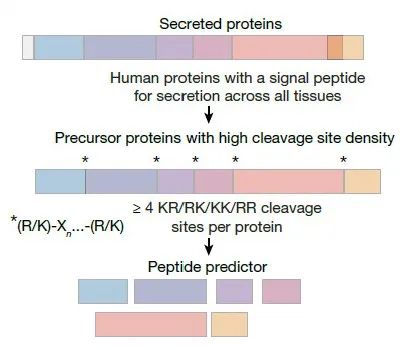
2. 肽片段预测:接下来,研究人员利用Peptide Predictor预测了人类分泌组中可能被PCSK酶切割的肽片段,重点关注具有多个切割位点的前体蛋白[这里为什么是分泌组呢,因为这是激素的关键特征]。最终识别出373个前体蛋白,这些蛋白能够产生2683个肽片段。

此外,作者还将开源网站以及代码都公开了,可见其对科学秉承着的开放的精神。
研究人员还发现,许多预测的肽类大小与已知的G蛋白偶联受体(GPCR)配体相当。
[纸上得来终觉浅,接下来就要动手开展湿实验了!]
3. 肽片段的生物活性测试:研究人员合成了一种包含100种肽的文库,并在神经细胞系NS-1(神经细胞抑制食欲)和胰岛β细胞(胰岛细胞控制血糖)系INS1中[这两个细胞系,一个看食欲,一个看血糖]评估这些肽对Fos基因表达的影响,以此评估肽的生物活性。正如预期的那样,发现GLP-1在INS1细胞中诱导了大约三倍的Fos表达增加,而神经生长因子(NGF)在NS-1细胞中诱导了大约十倍的Fos表达增加。而在测试的肽类中,鉴定出了BRP(一种由BRINP2衍生的12残基肽),在两种细胞系中均诱导了超过十倍的Fos表达。
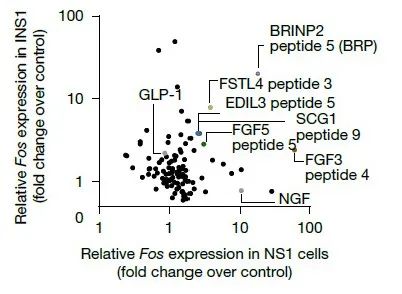
并且重复处理并未使细胞对BRP产生耐受性[没有耐药性]。
BRP的半最大有效浓度(EC₅₀)在1小时和24小时处理时均为大约30微摩尔,而GLP-1在具有内源性受体表达的细胞中EC₅₀为100微摩尔[说明想要达到同样的药物水平,GLP-1类的用药量要更多]。
[接下来,动物实验!]
4. 小鼠动物实验评估BRP:在小鼠在禁食16小时后,研究人员通过腹腔注射给予载体(生理盐水)或BRP,随后在3小时内测量食物摄入量。观察到BRP强有力且迅速地抑制了食物摄入。药代动力学研究表明,BRP的血浆浓度在注射后1分钟达到峰值,BRP在血浆中的半衰期不到10分钟[说明药效快,不过持续时间不会太长,作者还提到注射或口服均可]。
值得注意的是,这种抑制食欲的效果与GLP-1相似。然而,与GLP-1不同的是,BRP并未表现出任何胰腺活性,因为血糖水平和胰岛素分泌保持不变。
此外,在活动性、饮水量、通过旷场实验评估的焦虑样行为以及粪便颗粒计数方面,均未观察到差异,在旋转杆实验中并未引起协调困难,在强迫游泳实验中也未引起变化,对体温、胃排空或对蔗糖的偏好也无影响。此外,通过测量大鼠摄入高岭土的情况来评估,BRP并未引起异食癖。最后,又进行了条件性味觉厌恶实验,以确定BRP给药是否会引起厌恶和与恶心相关的不适反应。结果发现,BRP并未引起对糖精的厌恶[不会导致副作用]。
[继续动物实验!]
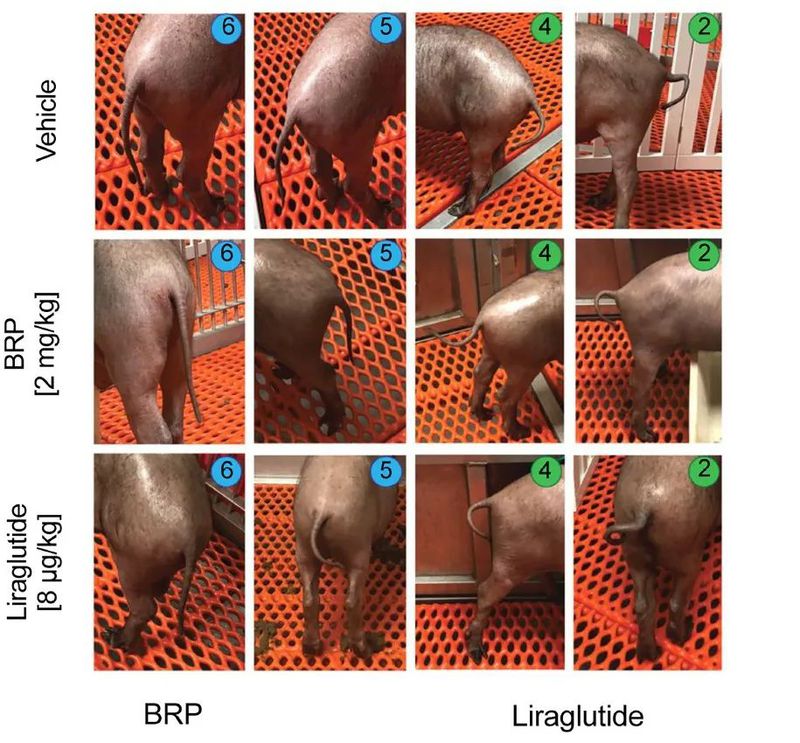
[2表示开心;4表示好动;5表示放松;6表示平静。是不是很有意思!]
6. BRP是否能够逆转已经患有肥胖症和糖尿病:通过对患有肥胖症和糖尿病的小鼠进行BRP注射,观察到累积食物摄入量更低,葡萄糖耐受性和胰岛素耐受性得到改善。此外,体重的减少完全是由于脂肪质量的减少[令人心动]。一系列的发现足以表明,BRP可以逆转小鼠的肥胖和代谢综合征。
7. 探索BRP的作用机制:研究人员通过磷酸激酶分析,鉴定出BRP诱导磷酸化的底物pCREBS133,并通过对底物的推测,选择进行抑制Gαs偶联GPCR信号传导,结果观察到对Fos基因表达的抑制。因此,BRP激活与Gαs偶联GPCR激活一致,导致神经细胞中pCREBS133和Fos活性。随后通过对小鼠的组织采集,观察到BRP激活下丘脑多个核团的FOS信号,但在后脑和脑干未检测到FOS激活。这些结果共同表明,药理性给予BRP可通过激活下丘脑POMC阴性神经元中的CREB-FOS信号通路发挥作用。
随后通过系统的突变,测试到L8A突变会改变BRP的脂溶性特征,进一步实验证实,Leu8是BRP直接激活神经元信号传导的必要条件。
肽激素:是一类在能量平衡调节中起关键作用的小分子(少于100个氨基酸),它们在肥胖治疗中具有吸引力。
前激素转化酶1/3(PCSK1/3):在肽激素的加工过程中起关键作用,例如在GLP-1(胰高血糖素样肽1)的生成中。
GLP-1:调节血糖,延缓胃排空以及增加饱腹感来降低血糖; 调节食欲:通过作用于大脑中的食欲调节中枢,增加饱腹感,减少食物摄入。 司美格鲁肽与GLP-1的关系:是一种长效胰高血糖素样肽-1(GLP-1)受体激动剂,主要用于治疗2型糖尿病。 GPCR:参与多种生理过程,包括:代谢调节:例如,胰高血糖素受体(Glucagon Receptor)和胰岛素受体(Insulin Receptor)等血糖水平调节;代谢性疾病:GLP-1受体激动剂(如利拉鲁肽)用于治疗2型糖尿病。 Fos基因:在食欲调节中发挥重要作用。肥胖小鼠的大脑中Fos基因的表达变化可能影响食欲调节中枢的功能,从而导致食欲增加和能量摄入增加。
公众号已建立“小药说药专业交流群”微信行业交流群以及读者交流群,扫描下方小编二维码加入,入行业群请主动告知姓名、工作单位和职务。
