
5月29日,前沿生物技术初创公司Vivodyne宣布完成由Khosla Ventures领投的4000万美元A轮融资,这笔资金将用于扩建位于旧金山南部的机器人实验室,进一步拓展“类器官+人工智能(AI)”自动化药物筛选平台。
这笔融资不仅金额可观,更踩中了一个关键时间窗口——2025年4月11日,FDA宣布将逐步淘汰传统依赖实验鼠和灵长类的动物模型,转向以类器官(organoids)与器官芯片(organ-on-a-chip)为代表的体外建模手段用于药物的毒性与疗效评估。这一改革将有助于提高药物预测准确性、加快评估流程,同时减少动物使用数量、降低研发成本,最终推动药价下降。
作为一家主攻类人组织平台与AI分析的企业,Vivodyne的落点恰逢其时。伴随FDA对动物实验逐步“去中心化”的政策推进,Vivodyne的平台恰好踩准“人源数据优先”药物开发路径,成为药企在早期评估环节的重要技术选项。
01
从宾大实验室出发,一家在车库里创办的Biotech
Vivodyne的起点是在宾夕法尼亚大学(University of Pennsylvania, UPenn)的一间生物工程实验室——这也是两位创始人理念碰撞的起点。
Vivodyne CEO Andrei Georgescu在攻读博士期间,加入了Dan Huh教授的Organ-on-a-Chip研究小组,专注于体外组织建模与药物反应预测。Dan Huh是organ‑on‑chip领域的公认先驱之一。早在2010年,在哈佛大学博士后期间,他就作为第一作者在《Science》发表了全球首个“肺芯片”模型[1],首度构建出具有呼吸机械动态和免疫穿膜功能的三维人体肺泡模型。
最初,Georgescu对这些复杂模型的可行性并不十分确信,直到有一天他在显微镜下亲眼看见细胞自组织出具有微血管结构的人体组织模型——“这怎么可能?没有我们,细胞是如何构建这些东西的?”这次震撼的观察使他转向探索如何将这些模型大规模放大,并真正用于人体前的疗效预测。
这一目标恰好呼应了Dan Huh的设想。后者擅长生理系统的构建,却在工程化放大方面遇到瓶颈,Georgescu刚好擅长系统集成与自动化平台搭建,两人一拍即合。2021年春天,他们在费城郊区的一间简易车库里正式创办Vivodyne,试图将这一跨越生物与工程、数据与实验的技术平台推向产业前沿。他们的目标简单而明确:打造一个可扩展、可预测的“类人组织”平台,在进入人体临床试验前,就通过体外模拟系统“预演”药物在人体中的反应。

图1:联合创始人画像
短短两年,Vivodyne从一个“车库项目”成长为累计完成7800万美元融资的创新企业,赢得了明星资本的迅速认可与支持——硅谷最负盛名的技术投资驱动型的VC Khosla Ventures,是OpenAI最早的投资机构之一。早在2023年,Vivodyne就完成了由Khosla Ventures领投的3800万美元种子轮融资;2025年5月,Khosla再度领投4000万美元A轮融资。
除Khosla外,Vivodyne还获得Kairos Ventures与CS Ventures等专注早期硬科技的基金支持。这一资本组合既汇聚了对“类器官+自动化+AI”路径的长期看好,也体现了产业界对其技术落地潜力的信任。
CEO Georgescu在接受Freethink采访时表示:“Vivodyne的产品不是模仿,而是建立一个真实、可预测的人类模型体系,改变药物开发的起点。”
02
建模上万个人体组织样本,用机器人+AI重构临床前试验逻辑
新药开发是一场低成功率、高投入的“豪赌”。传统流程往往从平板(2D)上的人类细胞开始,接着进入动物实验,最后才进入临床试验。然而,这一路径最大的问题在于“前后脱节”:动物模型与人体反应高度不一致,最终约90%的候选药物在进入人体试验后失败[2]。
此外,据美国国会预算办公室(Congressional Budget Office)测算,一款新药从立项到上市的平均开发成本接近20亿美元。高昂的研发成本、漫长的研发周期和极高的失败率,组成了创新药研发的高风险特性。
Vivodyne打造的解决方案,正是在药物发现及研发早期,通过“类人模型”,大幅提前对“药物在人体临床的反应”的判断,解决这一“投入巨大却难以外推”的结构性问题。其核心产品是一个集成类器官、器官芯片与机器人系统的自动化平台,从组织生长、药物处理、显微成像到数据采集,全流程几乎完全由机器人系统执行。
● 还原组织微环境,构建更接近“真实人类”的器官模型
Vivodyne的核心优势在于其高度还原人体组织微环境的能力。传统药物筛选多依赖二维细胞培养,这种方法虽然简便,但细胞在平面上的生长状态与人体内三维结构差异显著,导致药物反应的预测准确性受限。
相比之下,Vivodyne采用器官芯片和类器官技术,打造出带有真实三维结构、微血管网络和部分免疫细胞的类人体组织模型,使每一个“活体微环境”更接近人体实际状态。
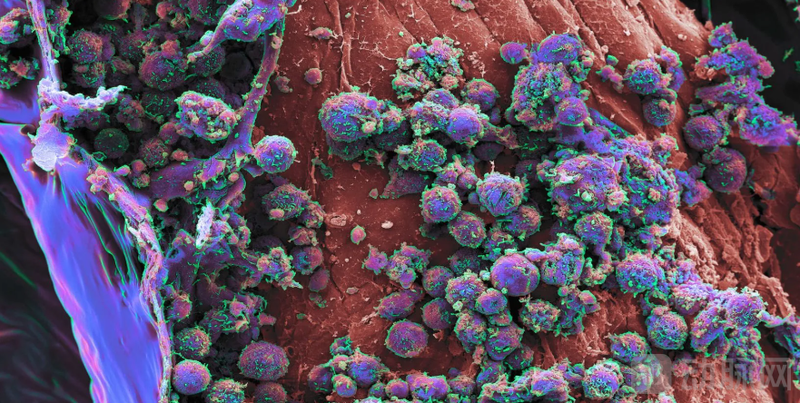
图2:类器官模型模拟人体免疫功能示意图
目前,Vivodyne已经成功构建超过20种人体组织模型,涵盖心肌、肺泡、骨髓、神经元、肝细胞、肾小管上皮等,覆盖药物ADME(吸收、分布、代谢、排泄)关键环节。
在模型通量和人源异质性方面,Vivodyne展现出显著优势。其平台可在单次实验中并行测试超过10000组组织模型,利用来自不同人类供体的原代细胞构建多样化的人体组织结构,显著增强了对个体差异的模拟能力。
相较于传统平台主要依赖标准化细胞系或动物模型的方式,Vivodyne平台产品能够更真实地反映人群在基因背景、疾病状态和药物响应等方面的差异性,为提高药物筛选的准确性提供了更具临床相关性的基础。
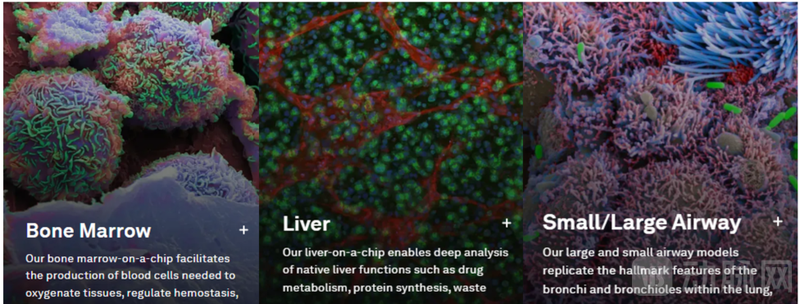
图3:骨髓、肝、气管模型示意图
● 机器人+预测性AI:从反应分析到疗法协同设计的“共创者”
除了生物学模型的突破,Vivodyne的另一大亮点是其AI驱动的分析平台。通过自动化的机器人系统,平台可在一次实验中同步培养并监测上万个组织样本,产生大量高维数据,如细胞形态变化、蛋白表达及单细胞测序等。
Vivodyne的AI平台不仅能准确识别并量化药物引起的细胞表型变化,还能通过主动学习(Active Learning)算法,持续优化实验设计,自动识别最具信息价值的组织模型条件,提高临床预测的精准度与实验效率。
更为重要的是,这套AI系统正在从被动的数据处理工具,逐步演变为药物开发的“智囊团”。它不仅帮助科学家洞察药物的作用机制,预测潜在副作用,还能识别药物组合的协同效应,推动新疗法的发现与优化。随着数据积累不断丰富,这套系统的预测能力也在逐步接近真实人体反应,帮助研发团队提前识别可能的疗效和安全风险,显著提高新药成功率。
尽管类器官平台在模拟复杂免疫机制等方面尚存局限,在伦理层面也有诸如类脑器官“类意识”或干细胞来源合规的讨论。然而,在全球范围内,监管政策正日益倾向于鼓励替代动物实验的创新路径。
早在20 世纪 80 年代,OECD (经济合作与发展组织)就开始采用体外试验进行遗传毒性测试,后续将基于体外替代模型的方法纳入测试指南(Test Guidelines Programme),鼓励采用非动物方法进行毒性与安全性评估。
美国NTP(国家毒理学项目)结合 NAMs(新方法)策略,倡导以人体来源细胞模型替代传统动物试验。2022 年底,美国通过《FDA Modernization Act 2.0》,正式取消对所有新药申报必须进行动物试验的法定要求,使“人体模型或AI模型”成为可替代路径。紧接着,2024–2025 年,FDA进一步发布“逐步减少临床前安全性动物测试路线图”(Roadmap for Reducing Animal Testing),优先在单克隆抗体领域试点非动物方法,并设立NAMs快速审核通道。
同期,欧盟通过“HCA|Organoid”计划(2020年)和器官芯片标准化路线图(2024年)支持替代技术,EMA(欧洲药品管理局)也在2023年修订指南,明确接受基于人体细胞的复杂体外模型数据。
总的来看,Vivodyne通过类器官与流体力学建模技术构建高通量、功能化的人体模型系统,在早期药效筛选和毒性评估环节中,可在一定程度上替代传统动物实验,提升人体预测相关性,有望显著缩短研发周期、降低前期成本,并在未来监管环境中获得更广阔的应用空间。
03
中国加速构建类器官药物开发基础设施
随着中国药监机构逐步认可基于体外数据的新药临床试验申请(Investigational New Drug,IND),国内在类器官与器官芯片技术平台方面,正在形成较为扎实的研发基础,并逐步展开产业化探索。
目前,国内各高校及孵化初创企业正积极布局organ-on-chip技术,研发体系已具雏形。
2024年,上海交通大学联合市卫健委与漕河泾园区,共同建设“医疗芯片创新转化中心”。该中心聚焦organ-on-chip技术的转化应用,旨在打通从实验室研究到产业落地的关键环节,推动高校与企业协同攻关,加速平台化能力建设。
2025年6月,清华大学刘鹏团队在Cell Stem Cell发表“胶-液界面”(GLI)免疫共培养模型,模拟肿瘤微环境并实现免疫反应预测。
此外,复旦大学、南方科技大学等高校也在肝脏、脑、肿瘤等方向开展类器官+芯片研究,国内类器官技术生态正逐步扩展,并向自动化、规模化、数据智能化方向加速演进。
另一方面,监管与标准体系也正逐步清晰。2025年4月,工业和信息化部等七部门印发《医药工业数智化转型实施方案(2025—2030年)》,提出加强AI与医药研发融合,建设新型数智化平台,为非动物模型的规模化应用奠定政策基础。
Vivodyne的实践表明,具备高度预测力的类人建模平台需深度融合生物工程、自动化机器人和机器学习技术,实现生物、工程与数据的高度协同。
未来,在政策利好与产业升级双轮驱动下,AI赋能的类器官药物开发平台正加速走向成熟,加快推动动物实验替代技术的发展。
参考文献:
[1] Huh D, Matthews BD, Mammoto A, Montoya-Zavala M, Hsin HY, Ingber DE. Reconstituting organ-level lung functions on a chip. Science. 2010 Jun 25;328(5986):1662-8.
[2] Sun D, Gao W, Hu H, Zhou S. Why 90% of clinical drug development fails and how to improve it? Acta Pharm Sin B. 2022 Jul;12(7):3049-3062.
如果您想对接文章中提到的项目,或您的项目想被动脉网报道,或者发布融资新闻,请与我们联系;也可加入动脉网行业社群,结交更多志同道合的好友。

近
期
推
荐



