在辉瑞全面终止GLP-1管线开发后,无疑礼来是最大受益者。尤其礼来口服GLP-1小分子激动剂备受期待。
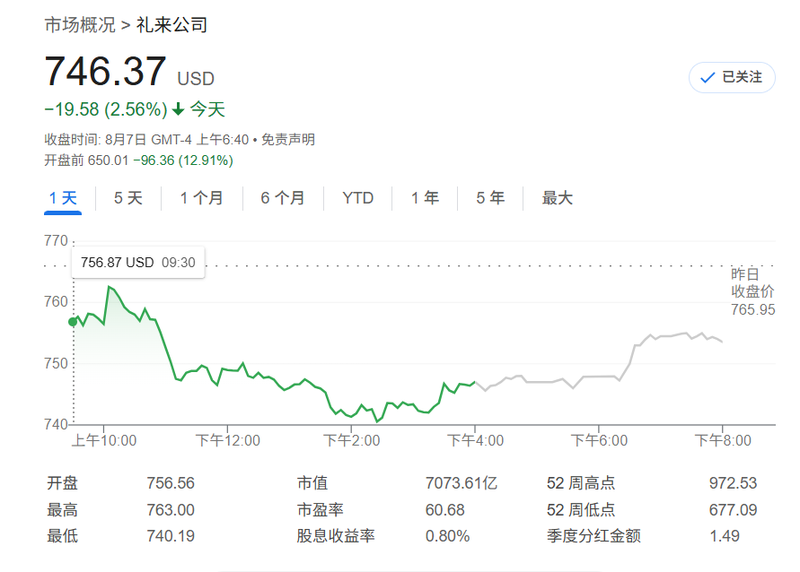
而礼来公司(Eli Lilly)周四表示,其GLP-1口服药物在72周治疗后,帮助肥胖患者体重最多减轻了11.2%。
这一结果低于分析师此前预期的大约15%的减重基准,也低于竞争对手诺和诺德(Novo Nordisk)旗下口服药物所实现的减重效果。因此在今日礼来应该盘前大跌近13%。这可能会影响国内众多公司。同时将重点转移到口服多肽层面。
备受关注的III期ATTAIN-1临床试验数据显示,Orforglipron的三个剂量组在体重减轻方面均显著优于安慰剂组,且呈剂量依赖性减重:服药者的体重减轻幅度在初始体重的7.5%至11.2%之间,而安慰剂组仅为2.1%。
这些III期数据基于“意向性治疗”(Intent-to-Treat, ITT)分析得出,该分析方法将不依从治疗的患者计为治疗失败,通常被认为是更为严格的统计方式。而在仅纳入依从治疗患者的“方案依从性”(Per-Protocol)分析中,Orforglipron所达成的最大减重幅度为12.4%,相比之下安慰剂组的体重下降不足1%。
诺和诺德(Novo Nordisk)目前正寻求美国FDA批准其重磅GLP-1药物Wegovy口服剂型的每日25毫克剂量。在一项名为OASIS 4的关键性临床试验中,该剂量在64周时实现了13.6%的体重减轻,而安慰剂组为2.2%(基于意向性治疗 [ITT] 分析)。
尽管Orforglipron与口服Wegovy的结果来自不同研究,不能直接进行对比,因为这并非头对头临床试验,但跨试验的对比仍然暗示,Orforglipron的减重效果可能相对较弱。
这一差距也在次要终点中得以体现:在意向性治疗(ITT)分析下,接受Orforglipron最高剂量治疗的参与者中,有55%体重减轻至少10%,36%体重减轻至少15%。相比之下,在OASIS 4试验中,口服Wegovy的相应数据分别为63%和50%。
安全性数据
在礼来公司的这项临床试验中,共纳入了3,127名超重或肥胖且伴有与体重相关健康问题但未患糖尿病的受试者。其中,在接受Orforglipron最高剂量治疗的患者中,因不良反应而中途停药的比例为10.3%,而安慰剂组为2.6%。相比之下,诺和诺德的OASIS 4试验中,口服Wegovy组的不良反应停药率为6.9%,安慰剂组为5.9%。
ACHIEVE-1是Orforglipron针对糖尿病的III期研究,其积极结果已于今年4月公布。
礼来将优先就Orforglipron在肥胖症适应症上提交上市申请,预计今年完成申报,最快可能于2026年获批。而口服Wegovy有望在今年年底前获得批准。
生产优势
不过在生产层面,礼来具备明显优势。Orforglipron是一种小分子药物,相较于诺和诺德的多肽药物,其制造过程更简单、成本更低。此外,礼来总部位于印第安纳波利斯,公司已提前储备了大量Orforglipron,一旦获得FDA批准,就能立即投放市场。
不过,诺和诺德也在为上市做准备。在周三的第二季度财报电话会上,公司首席财务官Karsten Munk Knudsen向分析师表示,预计明年将在美国“无供应限制”地推出口服Wegovy。
诺和诺德美国业务负责人Dave Moore也表示,公司将在尽可能接近获批时间点推出口服Wegovy。