DuoBody®是一种多功能的生物技术平台,用于生成双特异性抗体,这些抗体能够产生多种效果,包括同时招募免疫细胞和识别肿瘤细胞。
双特异性抗体为多种双重靶向应用提供了一种灵活的解决方案。它们可用于细胞受体的阻断、激活或下调;可用于招募并靶向T细胞;还可用于协助递送毒性载荷。
DuoBody®技术平台
Genmab的DuoBody®是一个经过验证的技术平台,用于双特异性抗体库的高通量生成和筛选,采用的是双特异性抗体格式。
DuoBody®平台技术涉及三个基本步骤,用于生成稳定的双特异性人源IgG1抗体。首先,分别生产两个IgG1抗体,每个抗体在第三恒定(CH3)结构域中均含有单一匹配的突变(第409位赖氨酸突变为精氨酸,K409R;第405位苯丙氨酸突变为亮氨酸,F405L),使用重组哺乳动物表达系统进行生产(见下图,步骤1)。随后,根据标准的回收和纯化流程对这些IgG1抗体进行纯化(见下图,步骤2)。生产并纯化后,在特定的实验室条件下将两种抗体重新组合,这一过程称为Controlled Fab-arm exchange,最终以非常高的产量(通常>95%)获得双特异性抗体产品(见下图,步骤3以及生产示意图)。
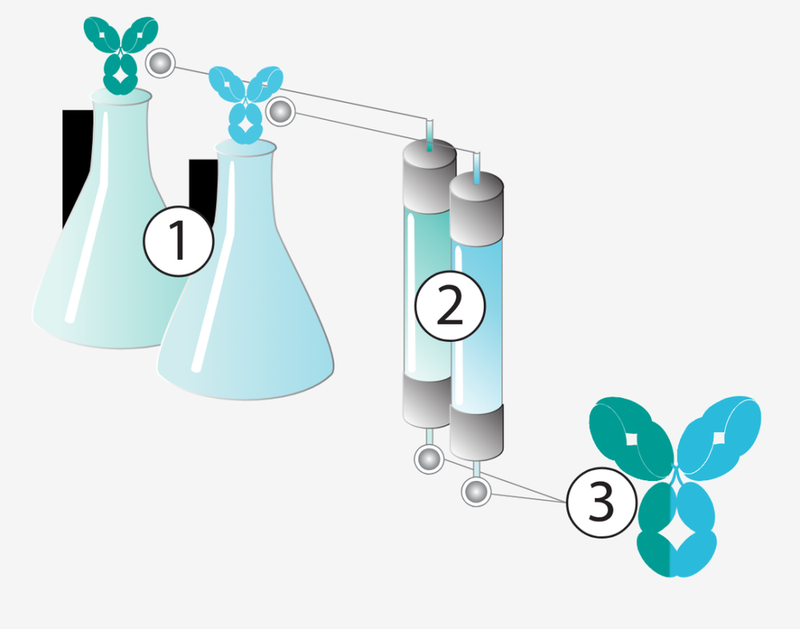
DuoBody®生产工艺:生成双特异性抗体的3个步骤。
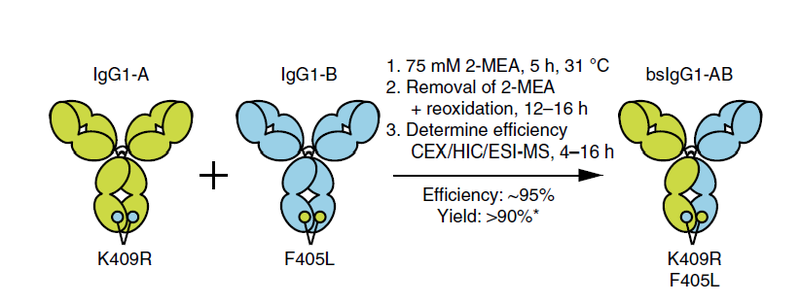
通过cFAE生产双特异性抗体示意图.图片来源:doi:10.1038/nprot.2014.169
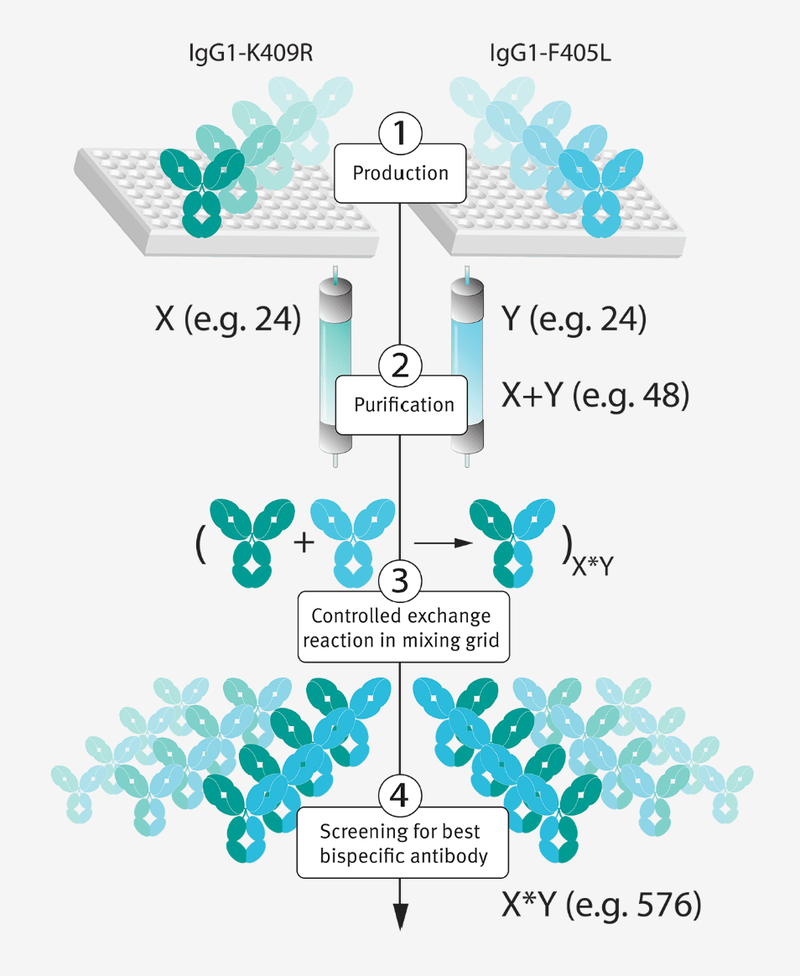
DuoBody®平台采用的简单后生产交换反应,可用于生成双特异性抗体库。X和Y代表抗体库。X+Y是需要进行的生产次数,而X×Y是在发现过程中生成的不同双特异性组合的数量。
如有需要,可以采用简单的精制步骤来获得本质上纯净的DuoBody®产品。重要的是,通过DuoBody®平台生成的双特异性抗体完全保留了IgG1的结构和功能(见下图)。
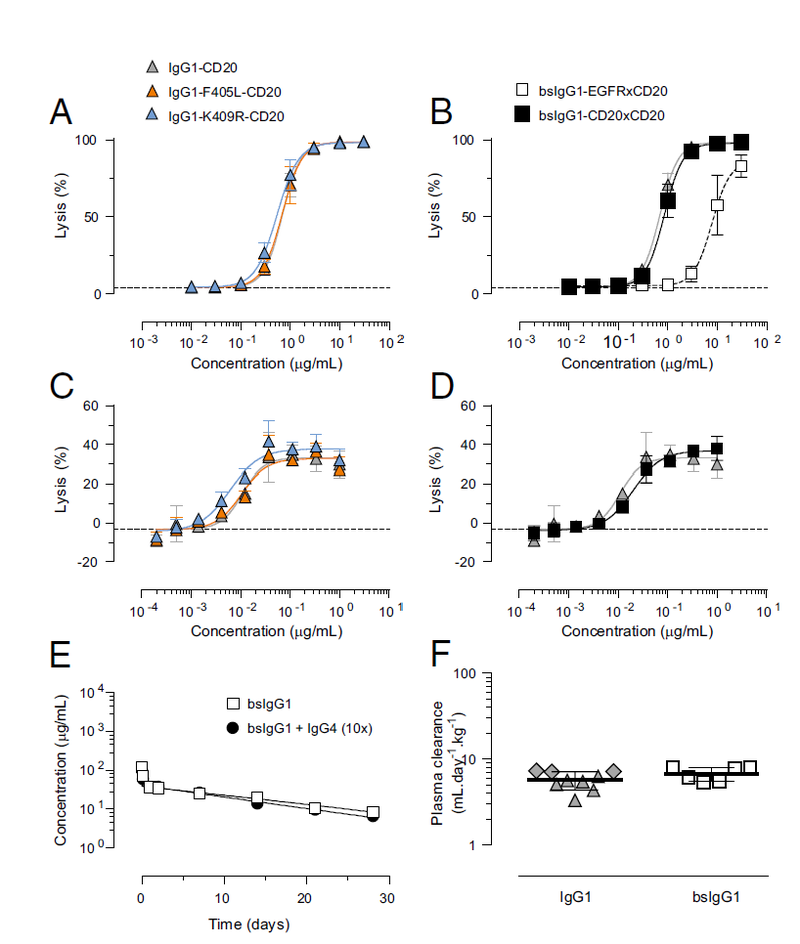
数据来源:doi/10.1073/pnas.1220145110
此外,DuoBody®平台还兼容额外的Fc工程突变,以满足特定应用的需求。DuoBody®平台的便捷性和多功能性也已扩展到小鼠(和大鼠)抗体,从而可以通过Controlled Fab-arm exchange高效生成替代性的双特异性小鼠IgG1、IgG2a和IgG2b(以及大鼠IgG1、IgG2a、IgG2b和IgG2c分子)(见下图)。
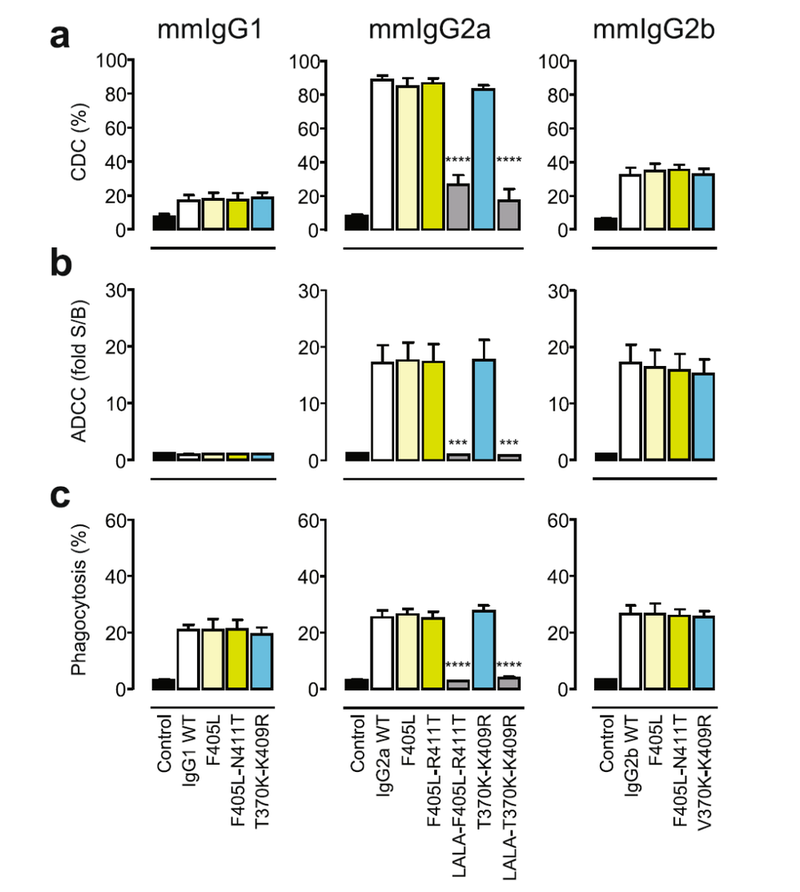
数据来源:DOI:10.1038/s41598-017-02823-9
DuoBody®平台的生物学意义
DuoBody®平台基于对抗体自然生物学的深入理解,旨在创造创新的治疗方法。
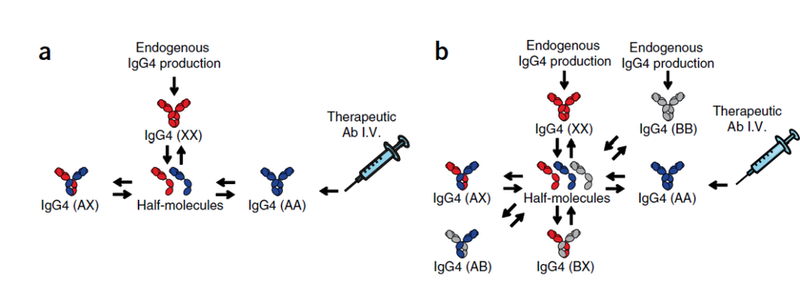
DuoBody®平台的灵感来源于对IgG4 Fab臂交换这一自然发生过程的广泛了解。要理解Fab臂交换的过程,回顾人免疫球蛋白G(IgG)抗体的结构组成至关重要。人IgG抗体分为四个亚类:IgG1、IgG2、IgG3和IgG4,它们具有不同的结构和功能特性。大多数IgG亚类是对称的,包含两个相同的抗原结合位点,因此这些抗体是单特异性的(即只能结合一种特定的表位)。人IgG4分子也是由B细胞产生的单特异性抗体。然而,一旦它们被B细胞分泌后,就可以参与一种独特的Fab臂交换过程,在此过程中它们会变成双特异性的。这一动态且随机的过程涉及从一个IgG4抗体中重组Fab臂(由一条重链与一条轻链结合而成),与另一个IgG4抗体的Fab臂进行交换。因此,形成了具有不同抗原特异性的Fab臂的IgG4抗体。
人体内的所有IgG4分子都参与了这种自然发生且持续不断的Fab臂交换过程。在人类中,能够参与Fab臂交换是IgG4所固有且独特的特性。有趣的是,双特异性抗体因此在人体免疫中自然产生。基于对IgG4 Fab臂交换的机制的广泛研究,发现铰链区和CH3结构域在Fab臂交换中都起着关键作用。更具体地说,铰链区第228位的丝氨酸(S228)和CH3结构域第409位的精氨酸(R409)(见下文)被证实是允许IgG4抗体参与Fab臂交换的关键氨基酸残基。
铰链区第228位的丝氨酸(S228)是允许IgG4抗体参与Fab臂交换的关键氨基酸残基
体外实验:在存在GSH的情况下,野生型IgG4(如IgG4-EGFR和natalizumab)发生了Fab臂交换,而含有S228P突变的IgG4(如IgG4S228P-EGFR)则没有发生交换。
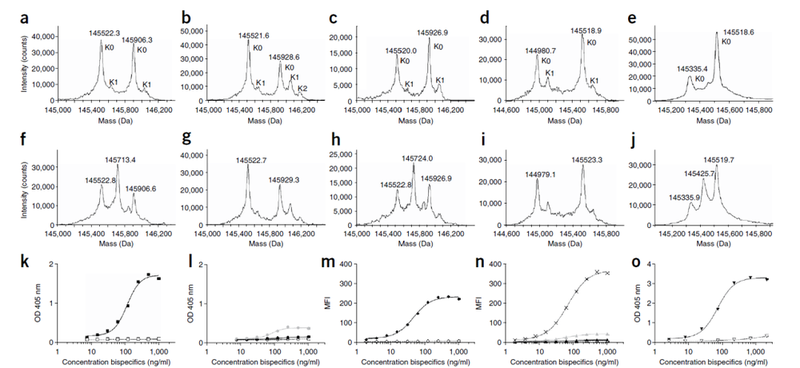
IgG4-CD20与IgG4-EGFR(a、f)、IgG4S228P-EGFR(b、g)、natalizumab(c、h)、gemtuzumab(d、i)和TGN1412(e、j)。数据来源:DOI: 10.1038/nbt.1553
体内实验:只有含有野生型IgG4分子的混合物(如IgG4-EGFR和natalizumab)在小鼠血液中产生了双特异性抗体,而含有S228P突变的IgG4(如IgG4S228P-EGFR)或IgG1分子的混合物则没有产生双特异性抗体。
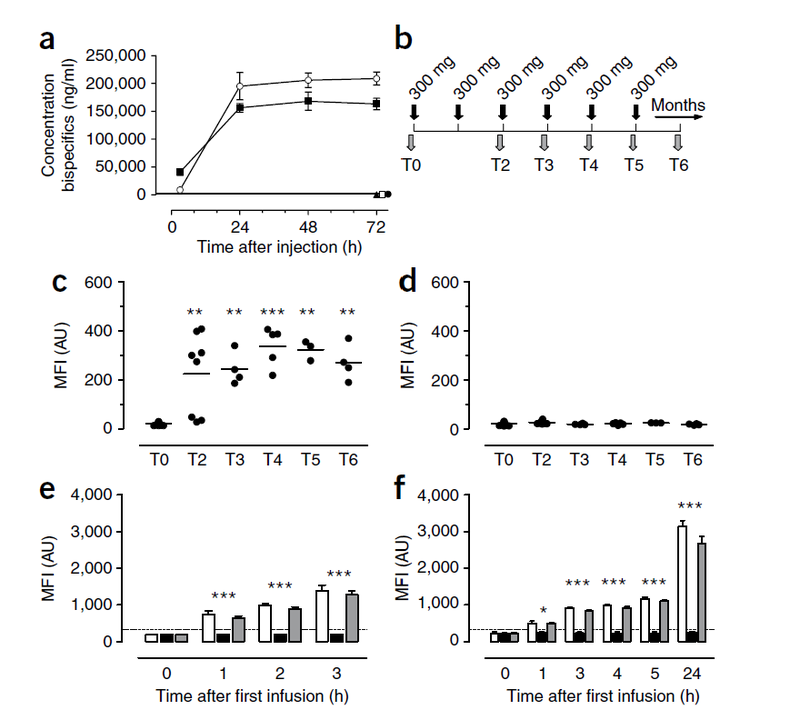
IgG4-CD20/IgG4-EGFR(开放圆圈)、IgG4-CD20/IgG1-EGFR(开放正方形)、IgG4-CD20/IgG4S228P-EGFR(闭合圆圈)、IgG4-CD20/natalizumab(闭合正方形)和IgG4-CD20/gemtuzumab(闭合三角形)。数据来源:DOI: 10.1038/nbt.1553
药代动力学模型中的S228P突变:S228P突变通过稳定核心铰链区,显著减少了治疗性IgG4抗体与内源性IgG4之间的Fab臂交换,从而提高了药物的稳定性和安全性。
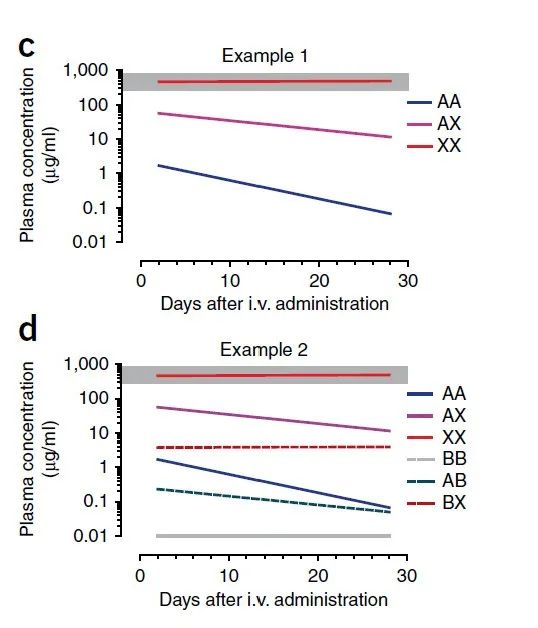
数据来源:DOI: 10.1038/nbt.1553
CH3结构域第409位的精氨酸(R409) 是人类 IgG4 发生 Fab 臂交换的关键 CH3 决定因素
解离常数(KD):通过CH3-CH3相互作用的KD值看出,IgG4的KD值约为4.8×10^-8 M,而IgG4-R409K的KD值约为8.0×10^-9 M,表明R409K突变显著增强了CH3-CH3的相互作用。只有当CH3–CH3相互作用足够弱时,才会发生高效的Fab臂交换。
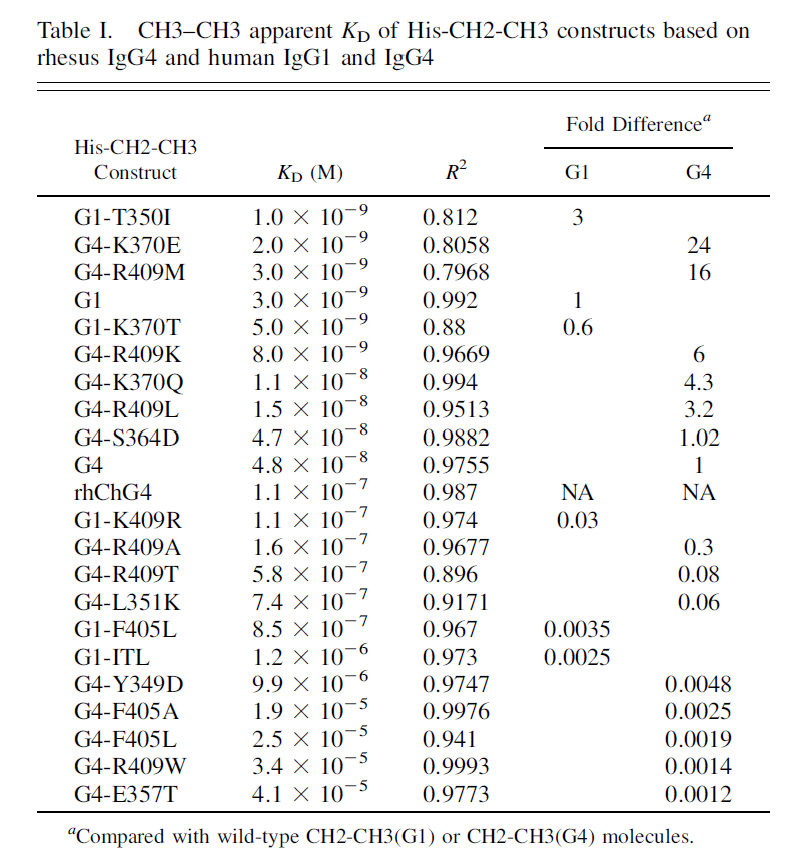
数据来源:DOI: 10.4049/jimmunol.1003336
Fab臂交换效率:在体外实验中,野生型IgG4在24小时内可达到约50%的双特异性抗体生成效率,而R409K突变体则无法检测到双特异性抗体的生成。
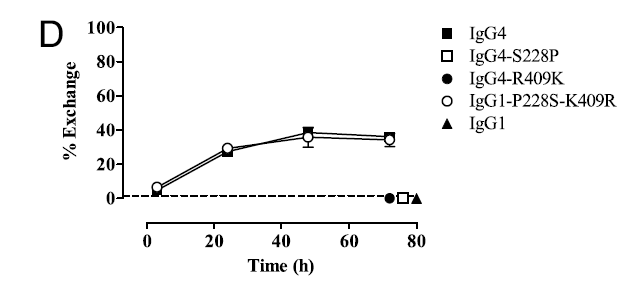
数据来源:DOI: 10.4049/jimmunol.1003336
体内实验结果:在小鼠模型中,注射IgG4-EGFR和IgG4-CD20混合物后,3小时即可检测到双特异性抗体,24小时达到峰值,表明IgG4在体内也能发生Fab臂交换。
基于以上对IgG4 Fab臂交换机制的深入理解,Genmab开发出了用于生成稳定双特异性IgG1抗体的强大平台:DuoBody®平台。
自主思考时间
基于Genmab的Duobody平台上市的双特异性抗体药物
Teclistamab(商品名:Tecvayli®)
Epcoritamab(Epkinly®)
CD20(B细胞表面抗原CD20)主要在成熟B细胞上表达,调控其激活、分化和增殖,并参与B细胞受体(BCR)信号通路的调控,是B细胞淋巴瘤和白血病等恶性肿瘤的重要治疗靶点,而在前B细胞和浆细胞上则不表达。
Amivantamab(Rybrevant®)
EGFR(表皮生长因子受体):是一种酪氨酸激酶受体,广泛表达于多种细胞类型中,参与细胞增殖、分化和存活等生物学过程。在多种癌症(如肺癌、结直肠癌等)中,EGFR基因突变会导致其异常激活,从而促进肿瘤细胞的生长和存活。
c-MET(间充质上皮转化因子):是一种受体酪氨酸激酶,参与细胞增殖、迁移和存活等过程。c-MET基因的异常激活(如扩增、突变或过表达)在多种癌症(如肺癌、胃癌、肝癌等)中较为常见,与肿瘤的侵袭性和预后不良密切相关。
Talquetamab(Talvey®)
GPRC5D(G蛋白偶联受体C类5成员D)是一种在多发性骨髓瘤(MM)细胞中高表达的孤儿受体,主要在毛囊等硬角化组织中表达,其激活可促进细胞增殖、生存和迁移,与MM患者的不良预后相关。
Talquetamab获批用于治疗既往接受过至少三线治疗(包括蛋白酶体抑制剂、免疫调节剂和抗CD38抗体)的复发或难治性多发性骨髓瘤(R/R MM)成人患者。
总结
基于Genmab的Duobody平台开发的双特异性抗体药物在肿瘤治疗领域取得了显著进展,已有4款药物获得FDA批准上市,分别针对不同的肿瘤靶点,为患者提供了新的治疗选择。