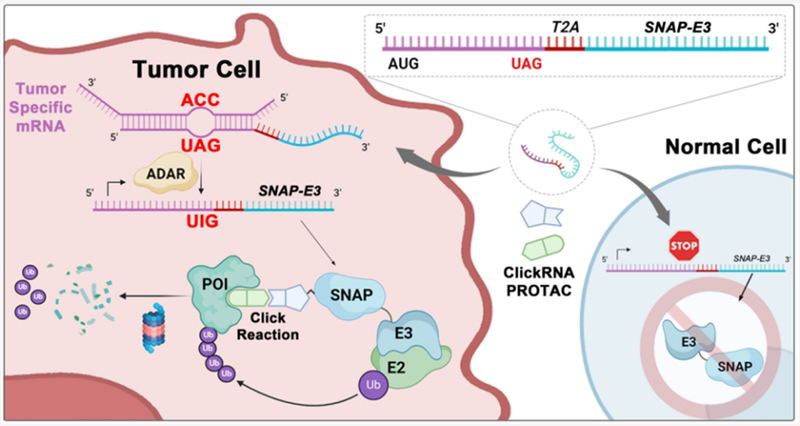
9月25日,清华大学李景虹院士研究团队在《Journal of the American Chemical Society》期刊上发表了重要研究成果,该研究团队开发了一种ClickRNA-PROTAC系统,该系统通过mRNA转染表达E3泛素连接酶SIAH1和SNAPTag的融合蛋白,并使用生物正交点击化学招募靶蛋白(POI)。该策略只需更换弹头分子,即可有效降解BRD4、KRAS、NF-κB等多种蛋白质。ClickRNA-PROTAC克服了不同肿瘤之间E3酶表达水平差异的限制,拓展了PROTAC技术的应用范围(图1)。
目前,临床阶段的PROTAC药物主要通过招募E3泛素连接酶VHL和CRBN来介导靶蛋白的泛素化,从而实现蛋白降解。然而,由于不同肿瘤中E3泛素连接酶的表达水平存在差异(图2),这限制了PROTAC药物在癌症治疗中的应用范围和疗效。此外,PROTAC分子缺乏对肿瘤的特异性,可能会在正常细胞中引起靶蛋白的降解,从而对正常细胞造成损害,并可能产生不良副作用。因此,迫切需要开发不依赖内源性E3连接酶的肿瘤选择性PROTAC药物。
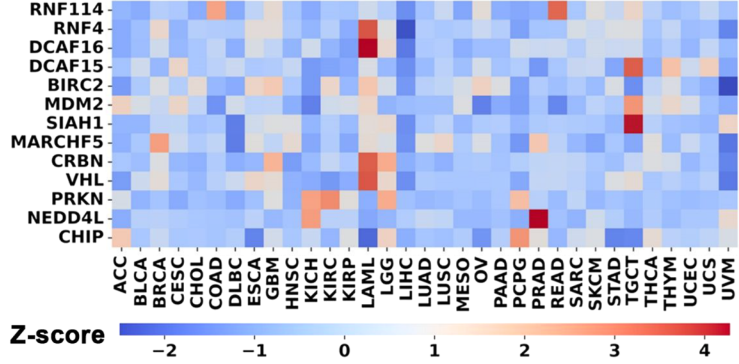
图2 13种具有代表性的E3泛素连接酶在不同肿瘤中的相对表达量热图
01
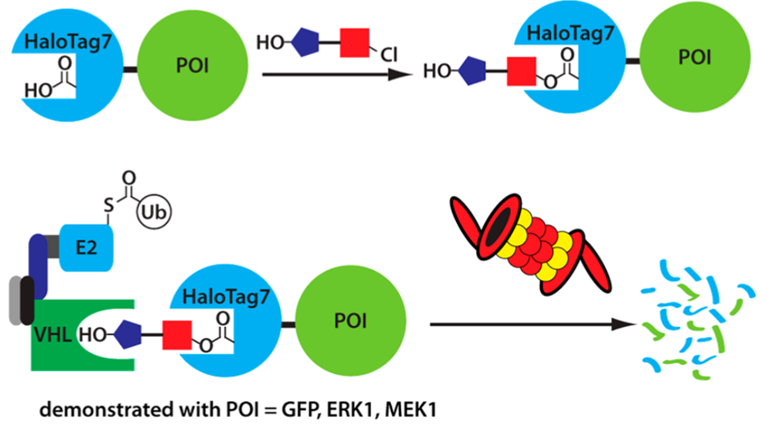
图3 HaloPROTAC的技术原理
02
mRNA疗法是一种革命性的技术,它通过利用mRNA来指导细胞产生治疗性蛋白,展现出治疗多种疾病的潜力。自从mRNA新冠疫苗成功应用于临床以来,mRNA技术在疫苗开发和疾病治疗方面取得了显著进展(图4)。在疫苗开发方面,mRNA技术正在被用于开发针对流感、巨细胞病毒(CMV)和呼吸道合胞病毒(RSV)的疫苗。mRNA疫苗的优势在于它们可以快速设计和生产,以应对快速变异的病原体。
在疾病治疗方面,研究人员正在探索使用mRNA表达治疗性蛋白来治疗遗传性疾病、心血管疾病等。例如,mRNA可以被用来表达血管内皮生长因子(VEGF)来治疗心力衰竭。此外,mRNA也被用于CRISPR-Cas9等基因编辑技术,以治疗遗传性疾病。CRISPR/Cas9系统可以由Cas9蛋白和单链导向RNA(sgRNA)组成,通过sgRNA的导向作用在特定靶部位切割靶基因,实现基因编辑。在肿瘤靶向治疗方面,研究人员正在开发以细胞类型特异性方式调节mRNA编码蛋白翻译的方法。例如,合成的内含子可以被肿瘤细胞中的剪接因子突变激活,导致肿瘤细胞靶向剪接和mRNA的表达。此外,由腺苷脱氨酶RNA特异性(ADAR)介导的mRNA碱基编辑策略,称为CellREADR,可以以细胞特异性的方式诱导Ato-I对停止密码子UAG进行碱基编辑,从而激活下游蛋白的翻译。然而,这些方法尚未用于肿瘤靶向mRNA治疗的开发。
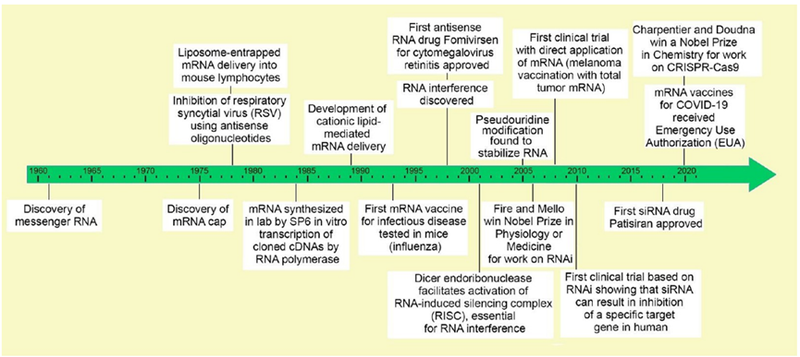
图4 主要RNA研究和发展里程碑的时间表
03
ClickRNA-PROTAC系统
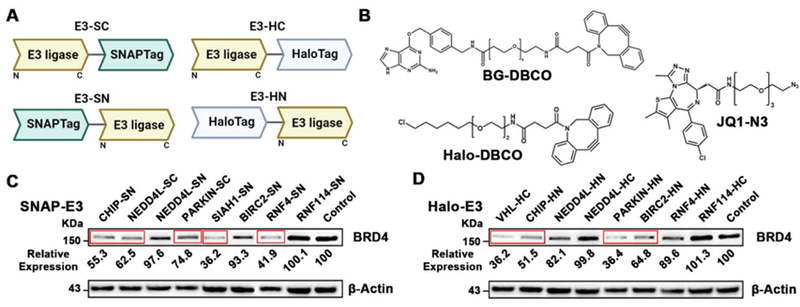
9月25日,清华大学李景虹院士研究团队开发了一种新型蛋白质降解技术ClickRNA-PROTAC,它结合了mRNA转染和PROTAC技术。该技术通过转染mRNA在活细胞中表达共价标签的E3泛素连接酶融合蛋白,并通过二苯基环辛炔(DBCO)修饰的配体使融合蛋白功能化,再利用点击化学将叠氮化合物偶联的POI配体连接到融合蛋白上,诱导POIs泛素化并降解。为了实现肿瘤特异性,该技术采用了基于UAG终止密码子的AI碱基编辑策略,调控mRNA的翻译。合成的mRNA由5′传感区和3′蛋白编码区组成,中间有一个UAG终止密码子,以防止初始状态下3′蛋白编码区翻译。在肿瘤细胞中,5′传感区与肿瘤特异性mRNA杂交,激活ADAR介导的A到I碱基编辑,使得原本的终止密码子UAG变为可翻译的UIG密码子,从而重新激活3′蛋白质编码区的翻译。研究人员构建了52种不同的Tag-E3融合蛋白,并在HEK293FT细胞中验证了它们的表达水平。其中,SIAH1-SN、VHL-HC和PARKIN-HN等16种融合蛋白表达良好,能有效降解BRD4蛋白(图5)。
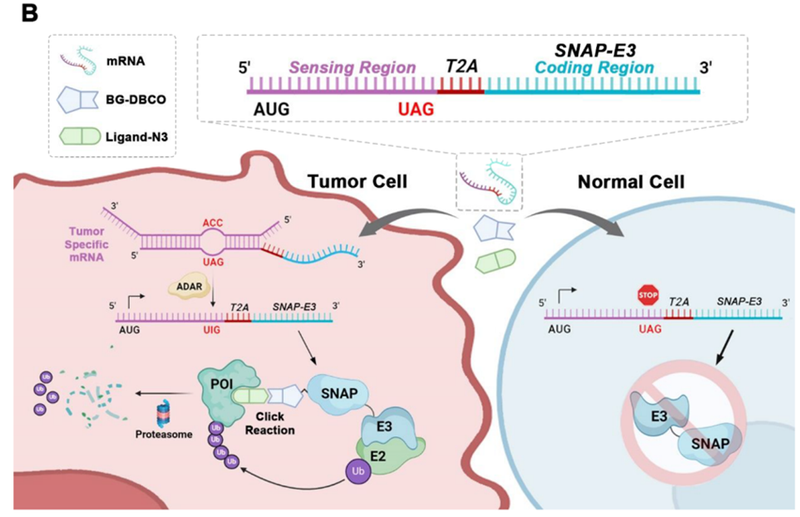
ClickRNA-PROTAC系统通过mRNA形式递送,能有效降解KRAS和p65蛋白,且具有剂量依赖性。此外,该技术还能特异性激活肾上腺皮质癌效应蛋白的翻译,而不影响正常细胞。在裸鼠肿瘤模型中,ClickRNA-PROTAC显著抑制了肿瘤生长,且与传统的PROTAC相比,具有更优越的抗肿瘤效果(图6)。治疗后小鼠的主要脏器未发现明显组织损伤,表明ClickRNA-PROTAC具有较好的安全性和选择性。
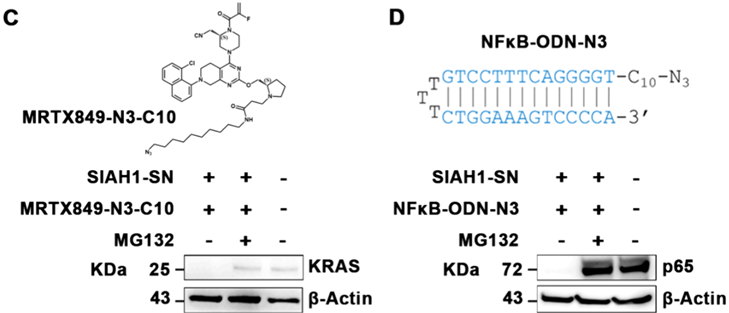
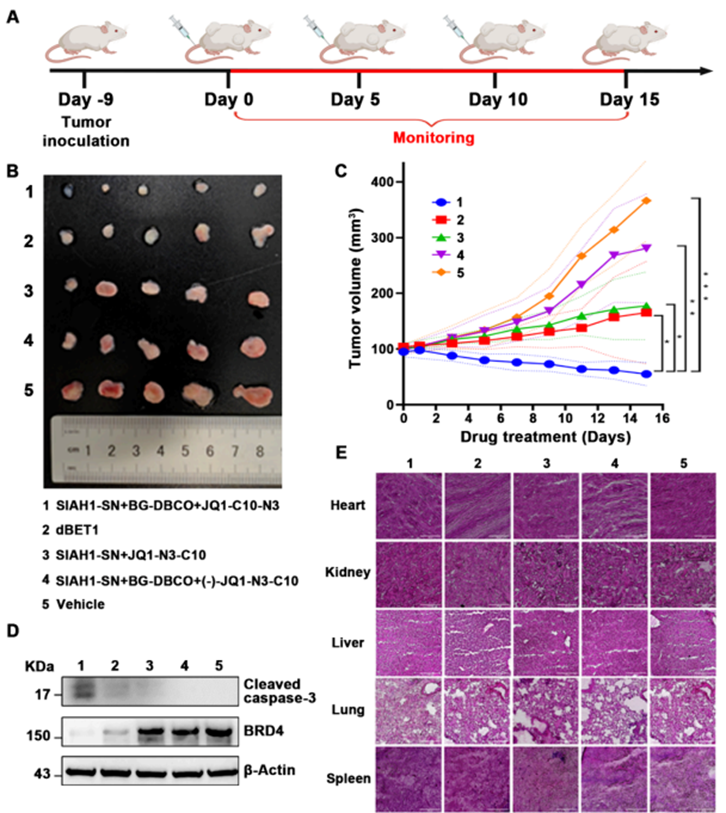
图6 ClickRNA-PROTAC靶向蛋白降解能力以及体内肾上腺皮质癌的靶向治疗
04
结语
ClickRNA-PROTAC技术展现了高效降解靶蛋白的能力,并且具备几大显著优势:它不依赖于细胞内源的E3泛素连接酶,能够实现肿瘤细胞的选择性作用,并且具有高度的可编程性。这些特性为PROTAC药物的研发和其在临床上的潜在应用开辟了新的道路。总体而言,ClickRNA-PROTAC技术代表了一种治疗肿瘤的创新策略,它通过精确降解肿瘤细胞内的特定蛋白质靶标,有潜力发展成为一个有效的临床治疗方案。
Ref.
[1] Mo J, Chen J, Shi Y, Sun J, Wu Y, Liu T, Zhang J, Zheng Y, Li Y, Chen Z. Third-Generation Covalent TMP-Tag for Fast Labeling and Multiplexed Imaging of Cellular Proteins. Angew Chem Int Ed Engl. 2022 Sep 5;61(36):e202207905. doi: 10.1002/anie.202207905.
[2] Buckley DL, Raina K, Darricarrere N, Hines J, Gustafson JL, Smith IE, Miah AH, Harling JD, Crews CM. HaloPROTACS: Use of Small Molecule PROTACs to Induce Degradation of HaloTag Fusion Proteins. ACS Chem Biol. 2015 Aug 21;10(8):1831-7. doi: 10.1021/acschembio.5b00442.
[3] Sasso JM, Ambrose BJB, Tenchov R, Datta RS, Basel MT, DeLong RK, Zhou QA. The Progress and Promise of RNA Medicine─An Arsenal of Targeted Treatments. J Med Chem. 2022 May 26;65(10):6975-7015. doi: 10.1021/acs.jmedchem.2c00024.