
2025年4月10日,美国食品药品监督管理局(FDA)发布了一项里程碑式的新政。
文件中表示,将逐步取消单克隆抗体等药物开发中对动物实验的强制要求,转而采用更具人类相关性的替代方法。

FDA的这份文件一经发出,很快引发了两波舆论。
一边是动物福利机构以及人道组织纷纷庆祝,并称:“这是一项意义重大的决定,对于行业和需要治疗的患者意义非凡。”
而另一边则引起了生物医药界的强烈讨论,不少大多认为FDA这一决定危险且激进,当前动物试验难以被AI以及类器官/器官芯片等新方法完全取代。
FDA 表示,该公告是在国会和科学界近年来敦促采用更多与人体相关的检测方法之后发布的。
根据最新的市场数据,全球实验动物市场的规模在2021年达到了约177亿美元,并从2015年以来以年复合增长率约9.4%的速度稳步增长。
究竟是FDA被动物保护组织裹挟,还是新方法前景广阔,有望完全替代动物实验?关于新技术的落地,我们跟几位业内人士聊了聊。
被绑架的FDA?
一向以严谨著称的FDA,如果被绑架你就眨眨眼。
事实上,如果一直关注FDA关于动物研究的政策,就会发现FDA近期发布的政策并不意外。
早在2022年9月,在各方力量的拉扯和推动下,拜登领导的美国政府就批准了一项法案——《美国食品药品监督管理局现代化法案》。
该法案修改了近80年以来的强制规定——从1938年开始潜在药物必须在动物身上进行安全性和有效性测试,FDA允许在动物或非动物试验后,将药物或生物大分子(如抗体)推广到人体试验。
与之相对应的,该法案正式确立了 3R原则(减少、改进、替换),转而利用更加科学的办法替代方法研究,以减少对动物的依赖。
等于说,该法案的通过为其他替代方案的法律依据撕开了一道口子,为之后的政策铺路。
这就不得不提到当时法案通过的背景:2022年整个市场“一猴难求”,食蟹猴单价飙升到19万元/只,美国市场实验猴价格甚至高达6万美元/只。与此同时,美国的实验猴大多由中国提供,被中国扼住供应链也让美国有了其他考量。
尽管法案通过掀起了不少波澜,但一位药物研发资深人士告诉智药局:这只是一项中长期政策,短期来看现有的很难取代动物试验。
于是,绝大多数企业仍然使用传统动物实验作为新药提交数据,并对新技术保持观望的态度。
但近日政策的不同点在于,FDA首次明确提出了药物研发动物实验替代路线图,并指出想要在3—5年内促使新的方法数据(NAM)成为FDA认可标准的计划。
1~3 年内,利用国际现有数据,减少重复动物实验,将单抗动物实验周期从 6 个月缩短到 3 个月。5 年内将 NAMs 数据库形成默认标准,在 NAMs 无法解决科学问题时使用动物实验。
毫无疑问,这一细化路线图即引发了舆论的强烈反应:不少业内人士认为,但想要3—5年就在行业建立标准可行的新方法,实在是过于激进。
事实上,FDA 主要展现出了对新技术的拥抱态度,新技术主要遵循3R原则,即改进减少、改进、替换当前的动物实验,而并不是完全禁止。
此外,FDA优先圈定了单抗药物的毒理动物试验作为优先试点项目,背后也反映了该领域的研发痛点。
长期以来,抗体药物发现一直面临着成本高涨的危机,以及抗体药物在动物实验预测效率不足的问题。
器官芯片公司耀速科技科学事务总监叶森向智药局分析:“我们研究路线图就发现,FDA推荐优先开展几个项目,包括单抗药物的肝脏毒性、心脏毒性以及跟物种差异较大的免疫相关模型。其实都是当前动物模型预测效果一般,希望用新的科学方法提高预测效果。”
新方法,靠谱吗?
要减少动物试验,就得寻找替代手段,FDA表示要在IND阶段引入“新型方法数据”(NAMs)。
FDA主要给出了两大方向:AI计算模型,以及基于类器官/器官芯片等体外微生理系统。
近年来,机器学习和人工智能方法越来越多应用于毒理学,AI的优势在于能够快速筛选化合物,预测不同物种的反应,以及进行风险评估等。
例如PBPK模型(基于生理药代动力学模型)在新药研发中扮演着愈发关键的角色,该模型能够应用于优化剂量与制剂设计、评估药物相互作用(DDI)与安全性、支持特殊人群用药等,加速研究发展。例如Brentuximab Vedotin就是全球首个依赖PBPK模型豁免DDI临床研究的ADC药物。
2022 年7 月,FDA 国家毒理学研究中心推出毒理学人工智能项目AI4TOX,旨在应用AI 方法来开发新工具。
但模型好不好,数据是关键。
这也是AI应用于药物研发的最大阻碍,当前高质量的药物毒理数据太少了,很多数据还因为数据保密原因无法共享。
此外AI模型在体外模拟的应用,以及模型验证和透明度,包括如何建立AI模型的行业标准以及量化不确定性,都是一个巨大的难题。
有相关人士表示,尽管AI模型预测药物反应进展迅速,但是它仍然依赖于现有的数据资源,对于未知的生理机制,可能反而会造成风险。同时AI受限于数据,AI在模拟人类复杂生理变化上也较为初级,短期完全替代动物实验并不现实。
从落地角度来讲,类器官和类器官则是呼声最高的替代动物实验的一种技术。
2022年8月,FDA批准了首个完全基于“类器官芯片”的免疫脱髓鞘药物,该实验结果由赛诺菲和器官芯片公司Hesperos合作完成。
与AI模型不同,类器官/器官芯片利用人源细胞构建了体外的测试系统,从而绕开动物试验评价,有望更加精准评估药物的安全性和有效性。
针对这一技术,FDA也做了充分的调研以及实验准备。从2017年开始,FDA就联合多家芯片供应商,将新技术引入实验室。
此外,FDA、EPA还联合十多家跨国药企共同发起OASIS Consortium,该组织旨在为下一代临床前药物毒性预测工具进行合作以及制定行业标准。
也就是说,为了测试类器官/器官芯片对于传统动物实验的替代程度,FDA多次进行了对新技术的可重复性展开评估,为行业制定质量控制与性能标准提供依据。FDA表示,器官芯片预测肝毒性的准确率达 87%,并已经被纳入 FDA 的 ISTAND 试点。
耀速科技向智药局分析道:“我们做过一个大致的统计,动物模型的准确率其实是在 50% ~ 65%,相比较之下体外模型的预测准确度集中在65%到90%之间,普遍高于动物模型的准确性。”目前耀速科技已作为中国唯一一家入选OASIS Consortium的公司,并和FDA签署联合试点协议。
与此同时,FDA计划于2025年启动试点项目,允许部分药企采用非动物测试策略开发单克隆抗体。首批成果将用于修订全球监管指南,推动多国采纳类似标准。
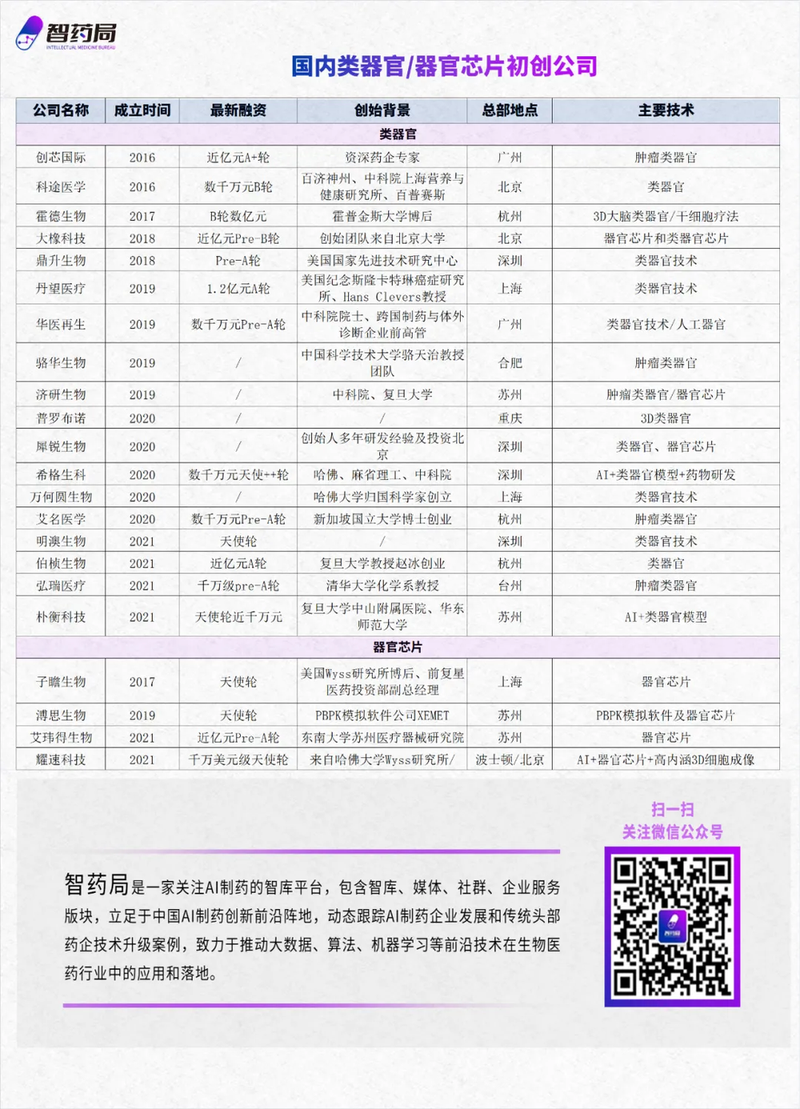
与此同时,国内有超20家公司布局类器官/器官芯片赛道,未来有望为药物发现深度赋能。
需要行业共建
实际上,该法案的不少利益相关方都对智药局表示:当前用新技术还无法完全替代动物试验,有希望在特定环节尽量减少动物实验。
也就是说,尽管FDA表示希望替代动物实验,但实际上行业仍然清楚还有很多技术、观念、监管上的障碍需要破除,需要行业多方努力。
FDA也看到了当前行业认知和监管的痛点,致力于搭建多元化的沟通平台,联合学术界及产业方深度对话和合作。
针对数据不足的问题,FDA希望建立一个国际人类药物毒性数据库,鼓励药企收集、分析和提供这些数据,FDA将在IND申请中慎重考虑这些数据。
对于FDA而言,该政策文件的发布企业能够考虑对新技术的采纳,从而提供更多的案例,促进监管政策的不断细化;对于有实力的企业,则能够联合技术方进行相关探索和验证,从而进一步推动技术与监管的良性循环。
据悉,如今全球top20的药企基本已经引进AI模型以及类器官/器官芯片平台,用于试点以及推进新技术的采纳,希望降低大规模药物筛选的成本。
2023年5月, 罗氏宣布成立人类生物学研究所(IHB),专注于推进类器官等人类模型系统领域的研究,通过提高对器官功能以及疾病如何发展的理解来加速药物的发现和开发。
显然,逐渐增长的新药研发成本,高失败率,也在迫使行业寻求能够更好预测药效以及毒性的方法。
与此同时,国内监管方也在推进新方法替代临床前动物实验评估。
2024年10月,国家药品监督管理局药品审评中心(CDE)发布了关于《模型引导的罕见病药物研发技术指导原则(征求意见稿)》。该文件明确指出,由于罕见病的特殊性,可用类器官和器官芯片探索性非临床研究。
2023年,恒瑞医药利用“心脏器官芯片”筛选出抗心衰新药HRS-1893,成为首个不依赖动物实验数据获批临床的国产创新药。
诚然,盲目且激进地取消动物实验,是对患者安全性以及企业发展的不负责任。
但以积极的心态拥抱新技术,审慎地科学态度面对实验结果,才有望弥合动物实验与药物研发之间的鸿沟,将药物更好的送入患者手中。