读懂隐匿的肺部“油”患,多图预警!
当患者反复咳嗽、胸片异常且常规治疗无效时,有一种罕见肺炎——外源性脂质性肺炎(ELP),正悄悄伪装成普通感染甚至肺癌。这种因油脂误吸引发的疾病,诊断如同破案,需要多维度线索。本文将带您抽丝剥茧,掌握ELP的7大诊断密钥。
不同物质误吸入气道及肺泡可能导致多种肺部并发症。由于右主支气管较左主支气管粗而直,上叶支气管开口朝下,异物受重力影响最易进入右下叶。类脂性肺炎(LP)是一种因动物性、植物性或矿物性脂质在肺部异常积聚所致的罕见疾病,可分为内源性与外源性两种类型。
表1 LP分类

秘钥1:重点人群关注——
拆解ELP发生的高危因素
年龄:婴幼儿及老年人
解剖异常:Zenker憩室、胃食管瘘、食管裂孔疝、胃食管反流、贲门失弛缓症
神经系统疾病:吞咽功能障碍或咳嗽反射受损(如帕金森病、卒中后)
精神疾病或意识障碍
儿童:强制喂油
胃食管反流患者:油脂浮于胃液表面,反流时易进入气道
危重症患者:鼻肠管喂养导致溶液反流误吸
查加斯病(巨结肠伴长期便秘):结肠功能障碍与巨食管倾向共同增加LP风险
秘钥2:临床蛛丝马迹——
解读ELP临床表现
LP的临床症状缺乏特异性,其表现因患者年龄、油脂摄入时长、误吸量和油脂性质而异。慢性咳嗽(偶伴咳痰)、呼吸困难是LP患者常见表现。少数患者出现胸痛、咯血、体重下降或间歇性发热。偶见呕吐、腹痛、吞咽困难、眩晕及晕厥等胸外症状。
LP患者体格检查可能正常,或出现叩诊浊音、湿啰音、哮鸣音或干啰音。多数患者影像学表现严重(如广泛肺浸润),但无症状,常通过常规胸片偶然发现。因表现非特异,LP应与细菌性肺炎(发热+咳嗽)、肺部肿瘤(如孤立性肺结节)、肺结核或囊性纤维化鉴别。
ELP的诊断需结合油脂接触史、影像学特征及痰液或支气管肺泡灌洗液(BAL)中检出脂质巨噬细胞,但需注意单一指标均无确诊意义。
密钥3:追踪暴露史——
隐匿的油脂接触
患者常遗漏油脂摄入史,多数在确诊后通过追溯病史(或询问家属)才明确暴露源。临床箴言:当“肺炎”对常规治疗无反应时,记得问一句:“您最近接触过油脂吗?”
ELP多见于使用油性泻药(如橄榄油、鱼肝油和石蜡油)治疗便秘,其次是慢性鼻咽疾病患者使用油性滴鼻剂。
其他罕见病因包括:
饮食相关:牛奶、罂粟籽油、蛋黄误吸
医疗操作:鼻胃管置入时误吸凡士林、长期睡前使用凡士林
职业暴露:接触纸板餐具工厂的石蜡雾、工业油喷砂、喷漆、塑料涂料
工业油误吸:机械加工(车削、铣削、磨削)中的润滑油或切削液、新车保护蜡清洗(高压热气喷射)、柴油虹吸
数据表明,约25%的成人LP无明确诱因。矿物油误吸常无察觉,因其不引发气道保护性反应(如声门闭合或咳嗽),夜间睡眠期间可能进入支气管树,损害纤毛运动并降低呼吸道清除能力。
密钥4:支气管肺泡灌洗术(BAL)揭秘“油滴”证据
支气管镜联合BAL检查可有效确诊LP,同时评估气道解剖结构以排除其他慢性迁延性肺炎的病因。LP患者BAL为乳白色浑浊液体,表面可见脂肪滴。细胞学检查观察要点如下:
脂质巨噬细胞(图1)是诊断外源性LP的重要依据,但非特异性发现;
细胞外油滴是外源性LP的特异性表现;
巨噬细胞形态:外源性LP可见大胞质空泡,内源性LP多为小空泡;
辅助技术:脂肪染色、化学分析(如红外光谱或色谱)可鉴定油脂类型。
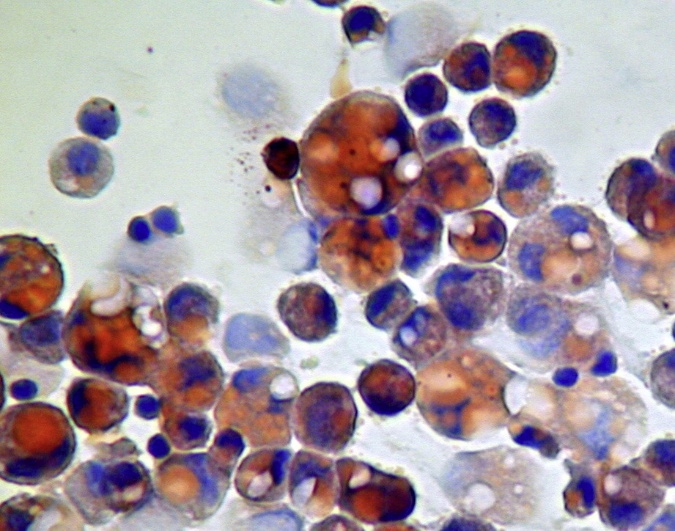
图1 支气管肺泡灌洗获取的肺泡巨噬细胞(油红O染色,×400),细胞质内充满大圆形空泡,迫使细胞核挤向边缘[1]
ELP急性期正常肺泡巨噬细胞减少,嗜酸性粒细胞及活化淋巴细胞轻度增多;停止油脂摄入后,正常及脂质巨噬细胞增加,淋巴细胞减少。测定脂质巨噬细胞指数(LLMI)有助于排除其他肺实质疾病。此外,BAL可清除部分油脂,对部分病例有治疗作用。
密钥5:影像学“脂”征
ELP的影像学表现多种多样且无特异性,部分患者临床症状不明显而影像表现却有较显著的改变;如果临床没有明确的油脂吸入史,仅凭影像学检查进行诊断比较困难。
▌胸部X线检查
胸片对误吸性疾病的诊断准确性较低。超过半数ELP患者无症状,仅因胸片异常被发现。表现多样且非特异,包括:局灶性或弥漫性炎症反应(可能无影像学异常);严重病例可见弥漫融合性实变(图2)、双侧模糊阴影、不规则肿块样病变、网状结节影、肺泡-间质混合病变或单/双侧结节。病变多位于中下肺叶,但上叶亦可受累。肺泡病变(局灶或弥漫)是最早期表现。

图2 胸片显示双肺中央区为主的广泛实变影[1]
▌CT
高分辨率CT(HRCT)是诊断LP的手段影像学手段。
常见表现:肺实变(图3)、磨玻璃影(图4)、铺路石征(图5)、小叶间隔增厚、气腔结节(模糊的小叶中心结节)及肿块样病变(图6),但均不是LP的特征性放射学特征。

图3 HRCT示双肺实变影伴支气管气相[1]

图4 HRCT示双肺弥漫性磨玻璃影(右肺为主)[1]

图5 HRCT示右肺上叶磨玻璃影叠加小叶间隔增厚(铺路石征),左肺正常[1]

图6 HRCT示右肺上叶后段肿块伴周围磨玻璃影[1]
儿童中肺实变更常见,成人更多见铺路石征。磨玻璃影或气腔结节的发生率无年龄差异。
LP最具诊断意义的CT表现是肺实变区域内存在负值衰减区(脂肪密度灶)(图7)。实际测量值往往高于纯油,这是因为油脂在受累肺实质中扩散并与肺纤维化和/或炎性渗出物混合所致。其他物质误吸,虽可产生类似类脂性肺炎的肺实变,但不会出现脂肪密度区特征。

图7 下肺层HRCT纵隔窗示右肺下叶实变区内低密度区(CT值-31~-116HU,↘)[1]
实变区域内检测到因脂肪衰减导致的CT值介于-150~-30HU的“低密度区”高度提示肺内脂肪沉积,尤其当患者有油脂接触史时更具诊断价值。
进行CT值测量时需格外谨慎以避免假阳性结果:
测量点应选择实变区最低密度部分;
需避开实变周边含气肺组织或支气管气相区域;
部分容积效应(含气肺组织与软组织平均)可能模拟脂肪特征性CT值。
需要注意的是:肺结节或肿块中的脂肪密度特异性较低,需与以下疾病鉴别:
肺内肿瘤:错构瘤、脂肪瘤
胸膜/纵隔/胸壁肿瘤:畸胎瘤、胸腺脂肪瘤、脂肪肉瘤
密钥6:病理确诊金标准
细针穿刺活检可用于LP诊断,但细胞学检查可能呈阴性(即使痰液中检出油脂成分)。其他微创技术包括经皮细针抽吸活检、经支气管活检、开胸活检等。
常规处理中的二甲苯等溶剂会溶解脂质,仅能使用冰冻切片。
表2 脂质特异性染色
慢性外源性类脂性肺炎的典型表现为:脂质巨噬细胞充盈并扩张肺泡及间质,伴随脂质堆积、炎性细胞浸润;纤维化程度不一(图8);可能伴随肺泡出血、炎性渗出。

图8 组织病理(HE染色,×40)肺泡腔充满脂质巨噬细胞,肺泡间隔内亦可见巨噬细胞浸润[1]
ELP在临床表现以及影像学表现上没有特异性,其诊断通常需要结合油基类物质吸入史以及在BAL中检出油滴或者是肺组织中找到含脂巨噬细胞。因为肺组织内存在含脂巨噬细胞也可能出现在其他疾病中,所以需要注意区分。
Diana Marangu等人在2019年提出新的ELP诊断量表[2],包括四个级别:
a.怀疑(没有BAL/冰冻切片肺活检评估);
b.可能(有BAL/冰冻切片肺活检评估,但未提及脂质染色);
c.很可能(BAL/冷冻切片肺活检细胞组织学显示脂质染色,但未见细胞外脂质);
d.在细胞学确定(BAL/冷冻切片肺活检细胞组织学显示脂质染色,同时可见细胞外脂质。
秘钥7:诊断后临床处理要点
▌一、并发症
1. 继发感染
可能发生非结核分枝杆菌(如偶发分枝杆菌、龟分枝杆菌)或诺卡菌感染,但较罕见。脂质环境可促进这些病原体生长,并抑制巨噬细胞的吞噬作用。
2. 肺纤维化
反复误吸可能导致不同程度的肺纤维化,职业性石蜡暴露引起的纤维化可能尤为严重。晚期病变周围肺组织可出现肺气肿样改变(因病灶体积缩小和牵拉所致)。
3. 呼吸衰竭与肺心病
严重者可进展为低氧性呼吸衰竭,甚至引发肺源性心脏病。
4. 高钙血症
可能与炎症细胞产生骨化三醇(calcitriol)有关,这一现象也见于其他肉芽肿性疾病(如结节病、结核病、系统性真菌感染)。
▌二、治疗关键:阻断源头+肺泡清洗
目前对于ELP的治疗国内外暂没有确切的指南或共识。常见的干预措施包括停止脂质暴露、糖皮质激素、抗生素和治疗性肺泡灌洗、肺内脂肪机械清除等,其中治疗性肺泡灌洗被逐渐认为是ELP的重要治疗手段,早期积极BAL对清除油脂、减少炎性细胞浸润、预防肺纤维化具有重要意义。激素的使用有争议,其对已形成的肺纤维化是无效的,但对重症者及进展者,为减轻炎性反应,建议全身使用[3]。
[1]Marchiori E, Zanetti G, Mano CM, Hochhegger B. Exogenous lipoid pneumonia. Clinical and radiological manifestations. Respir Med. 2011;105(5):659-666.
[2]D Marangu, Gray D, Vanker A, et al. Exogenous lipoid pneumonia in children: A systematic
review. Paediatric respiratory reviews, 2020, 33; 45-51.
[3]彭俊争,童志杰,曾森强,等. 儿童急性外源性类脂性肺炎的临床特征及随访研究[J]. 中华实用儿科临床杂志,2020,35(6):458-461.
