作者|小麦
2025 年 7 月 27–31 日,第 18 届阿尔茨海默病协会国际会议(AAIC 2025)在加拿大多伦多召开,带来了阿尔兹海默症领域重大进展,如Lecanemab的四年长期数据首亮相, Donanemab的TRAILBLAZER-ALZ 2三期研究长期扩展(LTE)阶段结果显示早期用药获益更大,Trontinemab 快速深度清除斑块以及血液生物标志物指南首发等。
癫痫病“新机制”药物研发呈现多点开花、快速推进的火热态势,包括KCNQ/Kv7 钾通道激动剂Azetukalner走向Ⅲ期, KCC2/NKCC1 氯离子转运体调节剂OV350从实验室到临床,5-HT2C受体超级激动剂Bexicaserin儿童发育性癫痫脑病(DEE)专研,神经活性类固醇Ganaxolone老靶点新剂型等等。
01
阿尔兹海默症发病机制
阿尔茨海默病(AD)是一种起病隐匿的进行性发展的神经退行性疾病,对大脑造成损害,占所有痴呆症病例的60 - 70%,随着老年化的加剧,AD患者越来越多。
AD的发病具体机制至今仍未完全破译,目前的研究主要集中在以下几个方面:
a. β-淀粉样蛋白(Aβ)级联假说;2. Tau蛋白异常磷酸化;3. 神经炎症等。Aβ传说是目前最经典的AD发病机制学说。淀粉样前体蛋白(APP)经过β-分泌酶(BACE1)和γ-分泌酶的异常切割,产生Aβ40和Aβ42两种主要的淀粉样蛋白。Aβ42更容易聚集形成寡聚体和淀粉样斑块,这些斑块沉积在大脑皮层和海马体等区域,干扰神经元的正常功能,导致神经毒性(图1)[1]。
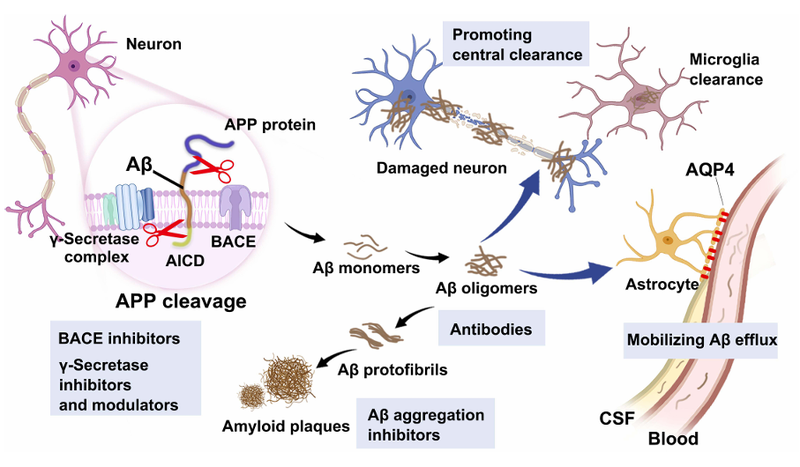
图1. Aβ蛋白的生成
AD巨大的市场吸引前仆后继,但是AD药物研发成本高、失败率也高,如诺华/安进的BACE1抑制剂umibecestat(CNP520)、罗氏的crenezumab、礼来的semagacestat、solanezumab以及lanabecestat、辉瑞与强生的bapineuzumab以及强生的atabecestat等都因没有达到临床终点而被终止。
2024年上半年,艾伯维的ABBV-916的中期分析结果显示,其疗效和安全性与已获批的Aβ单抗药物(如礼来的Donanemab和卫材/渤健的Lecanemab)相似,艾伯维因ABBV-916达不到差异化优势而终止其单药开发,AD的新药任重而道远。
目前靶向Aβ治疗AD的单抗新药先后有Aducanumab、Lecanemab和Donanemab获批上市,然而Aducanumab上市后表现并不佳,它的临床试验结果存在争议,部分试验未能显示出明确的临床效益,由于疗效争议、高昂的价格以及医保覆盖有限,2024年1月渤健正式宣布决定停止所有用于治疗阿尔茨海默病的 aducanumab的开发和销售。
Lecanemab是由卫材与渤健联合研发的Aβ单抗,于2023年1月6日首次获 FDA 加速批准上市,随后于2023年7月6日获得完全批准,近期,卫材在2025年的阿尔茨海默病协会国际会议(AAIC)发布了Lecanemab的最新研究数据,包括:
1. 四年长期疗效数据:连续治疗4年后,69%的早期AD患者在CDR-SB评分上未恶化或有所改善,显示出疾病进展的显著延缓,相比自然病程,lecanemab治疗4年可延缓CDR-SB评分下降1.75分,相当于显著延长早期阶段持续时间。
b.皮下注射剂型(Subcutaneous, SC)进展:卫材已开发出自注射笔(autoinjector),皮下给药与静脉给药的疗效和生物标志物变化一致,有望成为长期居家治疗的新选择。
c.中期真实世界数据显示:84%接受lecanemab治疗的患者保持稳定或临床改善,安全性与III期研究一致。
2025年1月,美国FDA基于Clarity AD及其扩展研究的暴露-反应模型已批准lecanemab的“维持治疗”方案:在完成18个月每两周一次的初始治疗后,可转为每4周一次10 mg/kg静脉维持治疗[2]。
Donanemab是由礼来研发的一种靶向N端焦谷氨酸化Aβ的单克隆抗体,于2024年7月2日首次获得美国FDA批准上市,用于治疗出现早期症状的阿尔茨海默病成年人,近期的AAIC会议上,礼来公布了Donanemab的TRAILBLAZER-ALZ 2三期研究长期扩展(LTE)阶段的结果:接受Donanemab治疗的参与者在三年随访中持续表现出认知衰退减缓,且这一获益随时间推移不断扩大,与来自阿尔茨海默病神经影像学倡议(ADNI)的未治疗外部对照组相比差异显著[3]。
研究还显示,即便推迟启动治疗,参与者仍可获益;但与推迟治疗者相比,更早开始使用Donanemab的参与者疾病进展至下一阶段的风险显著降低[3]。
AD的新药研发从未中断,目前在研的药物包括礼来的Remternetug、恒瑞医药的SHR-1707、罗氏的Trontinemab(RG6102)等(图2)。
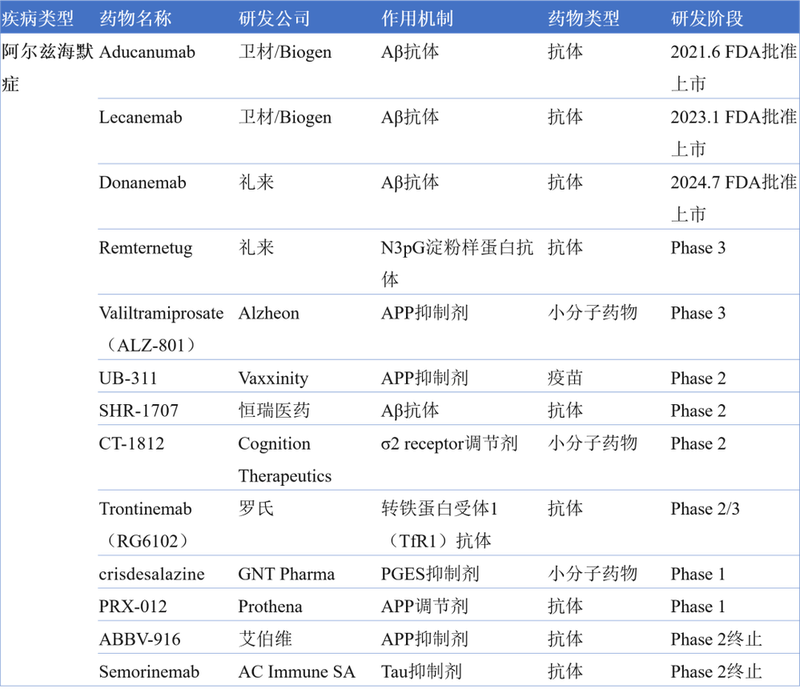
图2. 在研的阿尔兹海默症药物
代表性药物
Remternetug
Remternetug(LY3372993)是由礼来研发的新一代抗淀粉样蛋白(anti-amyloid)单克隆抗体,目前处于III期临床试验阶段,被视为阿尔茨海默病(AD)治疗从“对症治疗”迈向“早期干预甚至预防”的关键药物。
早期的临床数据显示,经过 6 个月的治疗,41 名接受测试的人中有 75% 的大脑中的淀粉样蛋白被清除。而 Donanemab则用了18个月,清除了72% 的患者的淀粉样蛋白。
2020年7月,礼来开启Remternetug在AD患者中进行单独的1期研究。 30名临床诊断为AD或AD痴呆引起的轻度认知障碍的参与者在九个月内接受多次递增剂量的抗体或安慰剂。主要结果是严重不良事件的数量;次要结果包括药代动力学和脑淀粉样蛋白从基线到第25周的变化。2021年,礼来在该试验中增加了第二部分,额外招募了32名第一代日本血统的健康成年人接受单次抗体或安慰剂输注。在2021年和2022年,入组人数上调了两次,最终为224人,治疗期增加到61周,并且该研究增加了皮下给药。该试验在美国10个地点和3个日本地点进行,将持续到2024年11月。
2023年3月至4月在瑞典哥德堡举行的AD/PD会议上,礼来公布了Remternetug的中期1期研究结果:Remternetug能够快速且稳定地减少AD受试者的淀粉样斑块。在41名患有轻度认知障碍或轻度至中度阿尔茨海默病痴呆的受试者中,Remternetug显示出剂量依赖性的淀粉样蛋白降低效果,且安全性、耐受性良好[4]。
目前,Remternetug正在开展多项临床试验,包括TRAILRUNNER-ALZ 2 Ⅲ期临床试验、TRAILRUNNER-ALZ 3Ⅲ期临床试验、Primary Prevention Trial预防性试验和国际多中心的Ⅲ期CTR20230785临床试验等。
2024 年 10 月,礼来启动了remternetug的一项在早期阿尔茨海默病患者中 的TRAILRUNNER-ALZ 3 Ⅲ期试验,目的是测量与安慰剂相比,接受remternetug治疗的患者因阿尔茨海默病而出现或恶化记忆、思维或功能问题的时间差异。
TRAILRUNNER-ALZ 3 研究计划招募1,200名参与者进行为期18个月的皮下注射家庭治疗,然后进行盲法观察,以临床痴呆评分的主要终点为进展时间。次要结果包括CDR-SB以及一系列认知、行为和功能测试、血清抗体浓度和不良事件。参与者的血浆pTau217必须与淀粉样蛋白病理一致,并且没有或轻微的认知或功能障碍。该试验包括一项淀粉样蛋白和tau蛋白PET子研究,以及一项开放标签扩展,计划持续到 2030年(图3)[5]。

图3. TRAILRUNNER-ALZ 3 研究计划
Remternetug具备“斑块清除更快、给药频率更低、干预时间更早”三大优势,有望在未来5年内成为首个获批用于“预防性治疗”阿尔茨海默病的药物。
SHR-1707
SHR-1707是由恒瑞医药开发的一种新型人源化抗Aβ IgG1单克隆抗体,能够特异性结合Aβ原纤维和单体,阻止Aβ斑块的形成,或促进小胶质细胞对Aβ的吞噬作用,用于治疗阿尔茨海默病(图4)。
在体外药效学研究中,SHR-1707显示出比Lecanemab更强的效力。
图4. 恒瑞神经类在研管线
恒瑞分别在中国(CHN研究)和澳大利亚(AUS研究)分别开展了SHR-1707的两项随机、双盲、单次递增剂量的I期研究。
CHN研究包括两部分,在第一部分中,符合条件的健康年轻成年人(18-45岁)按8:2的比例依次随机分配到SHR-1707(五个剂量组:2、6、20、40和60 mg/kg)或安慰剂组;在第二部分中,老年受试者(55-80岁)按8:4的比例随机分配到SHR-1707(20 mg/kg)或安慰剂组。AUS研究采用了类似的设计,但仅纳入健康年轻成年人,并分为三个剂量组(2、20和60 mg/kg)(图5)。
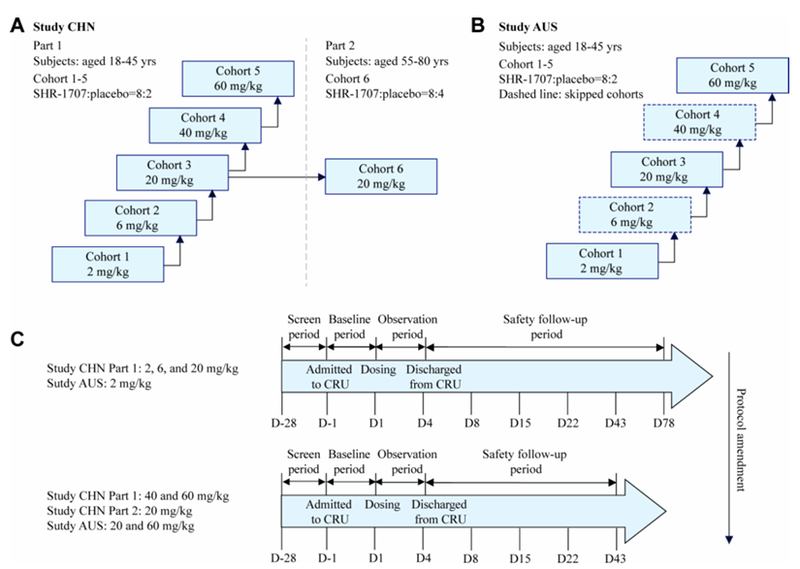
图5. SHR-1707的两项I期研究方案
在CHN研究和AUS研究中,分别有62名(第1部分/第2部分,n = 50/12;年龄范围,18-42岁/55-63岁)和30名受试者(年龄范围,18-42岁)接受了SHR-1707或安慰剂治疗。
在CHN研究中,所有与治疗相关的不良事件(TRAEs)均为轻度,在AUS研究中,TRAEs大多为轻度(SHR-1707组和安慰剂组各有1例中度事件);SHR-1707组中最常见的TRAEs为味觉异常和疲劳(各占8.3%)。
在两项研究中,SHR-1707的暴露量在2-60 mg/kg剂量范围内随剂量增加而略有超过剂量比例的上升;与安慰剂组相比,SHR-1707给药后血浆中Aβ42浓度呈剂量依赖性增加(图6)[6]。
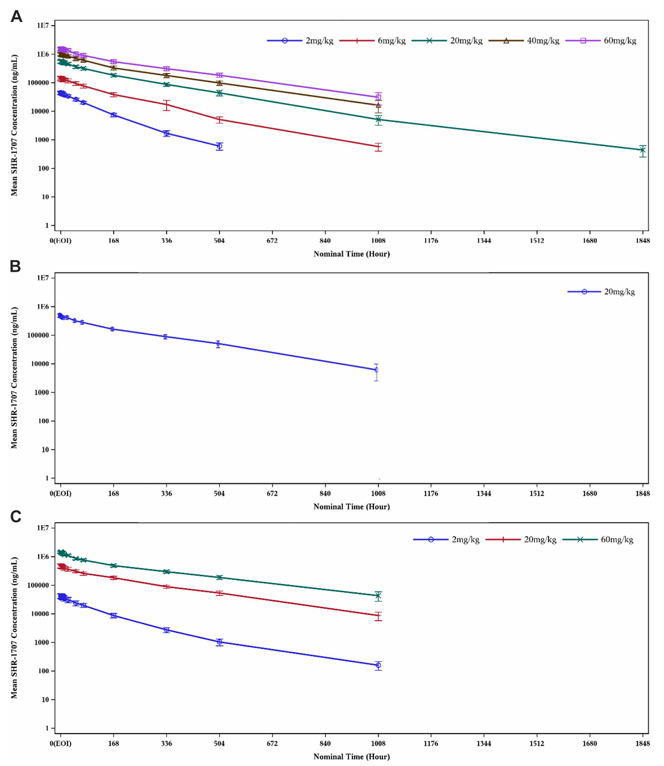
图6. SHR-1707的PK性质
目前SHR-1707正在进行II期临床试验,旨在评估SHR-1707在轻度认知障碍(Mild Cognitive Impairment, MCI)或轻度阿尔茨海默病患者中的安全性、耐受性、药代动力学和药效学。该试验计划在中国的一个中心招募45名患者,分为5、10、20或40mg/kg的剂量组,每两周给药一次,持续六个月,随后进行为期一年的开放标签扩展。
Trontinemab
Trontinemab 是由罗氏基于其专有的Brainshuttle技术,将β淀粉样蛋白结合单克隆抗体与转移受体(TfR1)穿梭模块相结合而得得一种双特异性2 +1淀粉样蛋白-β 抗体,专门设计用于增强进入大脑的通道,从而能够快速减少阿尔茨海默病患者的淀粉样蛋白。Trontinemab旨在有效运输穿过血脑屏障,以靶向聚集形式的β淀粉样蛋白并去除大脑中的淀粉样蛋白斑块(图7)。
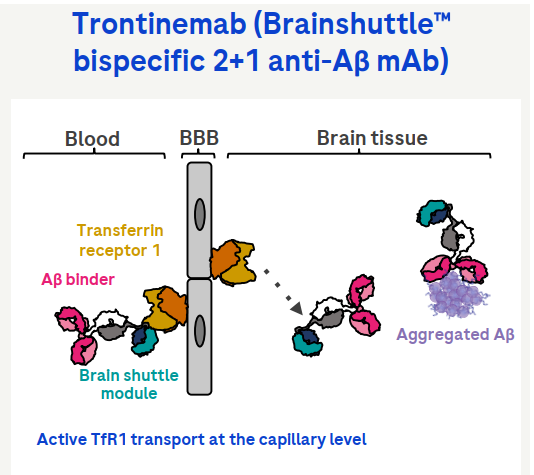
图7. Trontinemab结构与作用机制
2025年4月3日,罗氏在奥地利维也纳举行的AD/PD 2025阿尔茨海默病和帕金森病国际会议上公布了trontinemab的新数据。
在1.8 或 3.6 mg/kg双盲期内,114名参与者对trontinemab的初步结果表明,通过淀粉样蛋白正电子发射断层扫描(PET)测量,大脑中的淀粉样蛋白斑块快速、深入、剂量依赖性减少。
28 周后,Trontinemab在3.6 mg/kg 剂量组中将 81% 的参与者(n=21/26) 的淀粉样蛋白水平降低到24厘外阈值以下。阿尔茨海默病体液生物标志物的早期显著减少,包括脑脊液(CSF)和血浆中测量的总tau、磷酸化Tau(pTau)181、pTau217和神经颗粒蛋白(图8)[7]。
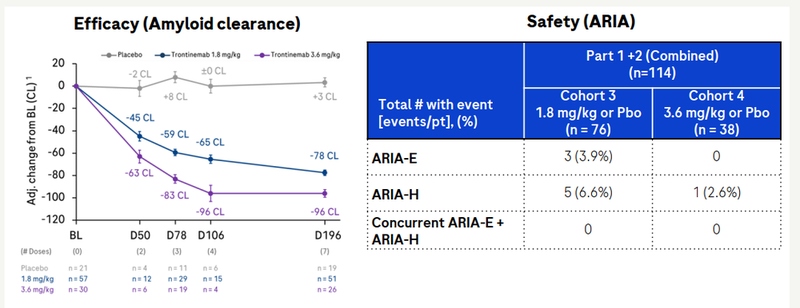
图8. Trontinemab的临床疗效
2025年7月28日,罗氏在今年的AAIC会议上宣布Trontinemab正在进行的 Ib/IIa 期 Brainshuttle™ AD 研究的最新结果,再次验证 trontinemab 能够快速、显著地减少脑内淀粉样斑块以及针对早期有症状阿尔茨海默病的 III 期 FRONTIER 1 和 2 研究的设计方案,计划于年内启动。
此外,罗氏今日还宣布,将在现有阿尔茨海默病开发项目中新增一项III 期试验,以评估 trontinemab在症状前阿尔茨海默病人群中的疗效。该试验将聚焦于认知衰退风险个体,旨在延迟或预防疾病进展至出现症状的临床阶段[8]。
02
癫痫病发病机制
癫痫是一种以反复癫痫发作为表现的慢性脑部疾病。由脑部神经元异常放电引发,疾病的发作有反复性和短暂性特点。
癫痫的发病机制复杂,涉及多种生物学过程和因素的相互作用,主要包括神经递质失衡、突触可塑性异常、离子通道功能障碍、炎症和免疫失调和氧化应激等(图9)[9]。

图9. 癫痫病的发病机制
目前的抗癫痫药物通过恢复兴奋性和抑制性神经递质的平衡来缓解症状,通过作用于产生动作电位的离子通道或调节突触传递的受体来减少神经元放电,但是,约30%的癫痫患者无法控制癫痫发作,急需新颖机制的抗癫痫药物,Ganaxolone是由Marinus Pharmaceuticals研发的一款GABA受体别构调节剂,于2022年3月被美国FDA批准上市,在两岁以上的患者中,用于治疗与细胞周期蛋白依赖性激酶样5(CDKL5)缺乏症(CDD)相关的癫痫发作,临床在研的新机制药物有Longboard Pharmaceuticals的Bexicaserin(LP352)、Neurocrine Biosciences的NBI-355和Cassava Sciences的Simufilam等(图10)。

图10. 部分在研的抗癫痫药物
代表性药物
Bexicaserin(LP352)
Bexicaserin(LP352)是由Longboard Pharmaceuticals公司研发的一种新型5-HT2C受体超级激动剂,2024年10月,灵北公司(Lundbeck)宣布以约25亿美元收购Longboard Pharmaceuticals,获得了bexicaserin这一潜在“best-in-class”疗法,主要用于治疗与发育性癫痫性脑病(DEEs)相关的癫痫发作。
2024年1月,Longboard公布了PACIFIC研究的积极顶线数据,PACIFIC研究是一项Ⅰb/Ⅱa期双盲、安慰剂对照的临床试验,旨在评估Bexicaserin在DEEs患者中的安全性、耐受性、药代动力学和疗效。
PACIFIC研究结果显示在75天的治疗期内,Bexicaserin组的癫痫发作频率中位数降低了53.3%,而安慰剂组的癫痫发作频率中位数降低了20.8%。
在特定DEEs亚型中,Dravet综合征患者癫痫发作中位数减少72.1%;Lennox-Gastaut综合征患者,癫痫发作中位数减少48.1%;其他DEEs患者:癫痫发作中位数减少61.2%,显示bexicaserin在减少癫痫发作频率方面具有显著效果(图11)[10]。
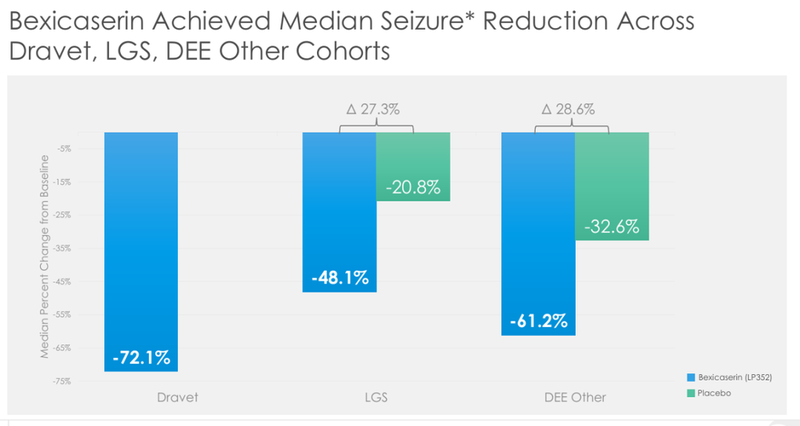
图11. Bexicaserin的PACIFIC试验结果
2024年7月1日,Longboard宣布美国FDA已批准其研究药物Bexicaserin的突破性疗法认证,用于治疗两岁或以上患者与发育性和癫痫性脑病(DEEs)相关的癫痫发作,包括Dravet综合征。
2024年11月12日,Longboard宣布已启动Bexicaserin其全球3期DEEp OCEAN研究,评估其研究药物贝昔卡色林用于治疗2岁及以上参与者与发育性和癫痫性脑病(DEE)相关的癫痫发作。
2025年1月39日,灵北制药 宣布了Bexicaserin为期 12 个月的 1b/2a 期 PACIFIC 试验的开放标签扩展的积极结果:在为期12个月的开放标签扩展研究中,Bexicaserin治疗组的可计数运动性癫痫发作频率中位数降低了59.3%。
从安慰剂组转为Bexicaserin治疗的患者,12个月时癫痫发作频率中位数降低了58.2%[11]。
Azetukalner
Azetukalner(XEN1101)是由 Xenon Pharmaceuticals 开发的一款高选择性、强效 Kv7.2/Kv7.3 钾通道开放剂,用于局灶性癫痫、原发性全面强直-阵挛癫痫发作以及重度抑郁症的治疗(图12)。
图12. Azetukalner的临床进展
2025年4月,Jacqueline 等人在Epilepsia Open 杂志上报道了azetukalner 在局灶性癫痫成人患者中的一项 IIb 期临床试验(X-TOLE)后进行的长期开放标签扩展研究的中期疗效与安全性分析结果。
285 名受试者完成了双盲期(DBP),其中 275 人(96.5%)进入开放标签扩展期(OLE),全部进入 OLE 的 275 名受试者中56.4%(155/275)和 44.4%(122/275)分别实现 ≥50% 发作减少(≥6 个月与 ≥12 个月连续无发作);28.4%(78/275)和 19.6%(54/275)分别实现 ≥90% 发作减少;22.2%(61/275)和 14.9%(41/275)分别实现完全无发作(100% 减少)的 ≥6 个月与 ≥12 个月连续期。
在OLE中已治疗≥24个月的165名受试者中34.5%(57/165)和 23.6%(39/165)分别实现 ≥6 个月与 ≥12 个月的完全无发作。大多数不良反应为轻度或中度,主要包括头晕、头痛和嗜睡,表明azetukalner耐受良好,无新增安全信号[12]。
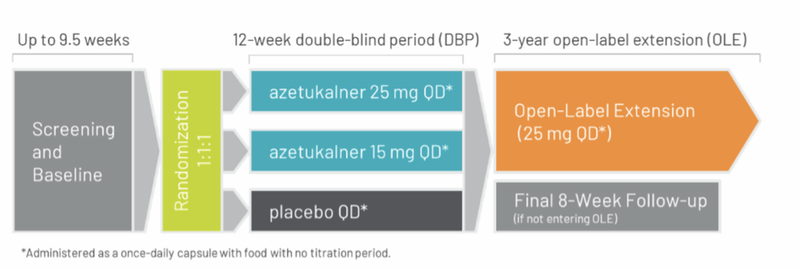
Azetukalner 正在进行两项X-TOLE2 与 X-TOLE3 实验,它们是两项完全相同的 III 期、多中心、随机、双盲、安慰剂对照试验,采用 1:1:1 随机、18 周双盲、固定剂量 25 mg/15 mg vs 安慰剂设计,主要终点为局灶性发作频率降低,旨在评估 azetukalner 作为附加治疗在年满 18 岁、已确诊局灶性癫痫、且正在服用 1–3 种抗癫痫药物(ASM)的成人患者中的临床疗效、安全性和耐受性,计划 2025 年底读出关键数据并支持 2026 年上市申请[13]。
小结
阿尔茨海默症和癫痫病的治疗药物研究不断进展,CNS药物开发难度大,失败率高,但是也都取得了进步,相继有获批和新颖机制的CNS药物,为患者提供了新的希望。未来的研究需进一步探索药物的机制、优化治疗方案,并关注药物对认知功能的影响。
公众号已建立“小药说药专业交流群”微信行业交流群以及读者交流群,扫描下方小编二维码加入,入行业群请主动告知姓名、工作单位和职务。