
文章解读+创新点拓展,为您带来科研新体验~
在现代医学研究中,单细胞核RNA测序(snRNA-seq)已经成为一种强有力的工具,它能够以前所未有的分辨率解析组织中的细胞组成。今年7月MIT蔡立慧团队联合Manolis Kellis团队在《Nature》杂志发表了一项研究——《Single-cell multiregion dissection of Alzheimer’s disease》,通过使用snRNA-seq技术,对阿尔茨海默病(AD)患者的多个脑区进行了深入分析,为我们提供了关于该疾病发病机制的新见解。本文将详细介绍这项技术及其在AD研究中的应用,并探讨其潜在的临床价值。
阿尔茨海默病是一种复杂的神经退行性疾病,影响着全球数以百万计的人口。尽管已经投入了大量资源进行研究,但对其发病机制的理解仍然有限。传统的大规模转录组学方法无法捕捉到细胞间的细微差异,而这些差异可能正是理解疾病的关键所在。单细胞RNA测序技术的出现为解决这一问题提供了新的途径。
在这项研究中,研究人员利用单细胞核RNA测序(snRNA-seq)对来自48名参与者的283个大脑样本进行了分析,涵盖六个不同的脑区,包括早期受累区域如内嗅皮层(EC),以及晚期受累区域如前额叶皮质(PFC)。经过严格的质量控制和数据分析流程后,最终得到了135万个高质量的细胞数据点,包含14个大类76个细胞细分亚型。揭示了不同脑区中神经元及胶质细胞亚型的详细分布情况。研究发现,某些特定类型的抑制性神经元在AD患者中的数量显著减少,这可能与疾病的进展密切相关。这些发现有助于我们更深入地理解AD过程中不同脑区细胞类型的动态变化。
 图1:老年人大脑六个不同区域的snRNA-seq分析
图1:老年人大脑六个不同区域的snRNA-seq分析
研究者通过snRNA-seq分析了6个大脑区域:在AD早期(I-II阶段)受影响的内嗅皮层EC;在AD中期(III-II期)受影响的海马皮层HC和前丘脑TH;在AD晚期(V-VI阶段)受影响的角回AG、颞中皮层MT和前额皮质PFC。神经元比例从TH(14.4%)到三层异位皮层HC(32.2%)、内嗅边缘皮层(36.6%)再到六层新皮层区域(AG、MT、PFC,58.9%)显著增加。胶质细胞,包括星形胶质细胞、少突胶质细胞、少突胶质细胞前体细胞(OPC)和小胶质细胞/免疫细胞,在新皮层样本中往往较少。
研究揭示了大脑中兴奋性和抑制性神经元的区域多样性。兴奋性神经元亚型在HC、EC和TH中高度特异性分布,而在新皮层中则有更多共通的亚型。丘脑中的主要兴奋性神经元亚型(NXPH1+ RNF220+)未在新皮层中观察到。相比之下,大多数抑制性神经元亚型在所有五个皮层区域中均存在,但一些亚型如PVALB+ HTR4+ 在新皮质中富集,而SST+ NPY+ 亚型在EC和HC中更丰富。此外,丘脑中发现了一种独特的MEIS2+ FOXP2+ 抑制性亚型,这种亚型表达多种谷氨酸能神经元基因,显示出嵌合特性。
 图2:基因表达模块注释区域的星形胶质细胞多样性
图2:基因表达模块注释区域的星形胶质细胞多样性
接下来,研究者检测了各类胶质细胞在大脑不同区域的转录特异性。在胶质细胞类型中,星形胶质细胞具有最高的区域异质性,比如高度新皮层富集型(GRM3+ DPP10+)和丘脑富集型(LUZP2+ DCLK1+)亚型。通过RNA原位杂交实验验证了星形胶质细胞转录的区域特异性。
研究者还开发了一套名为“单细胞去相关模块网络(scdemon)”的方法来识别高度相关基因的模块,以期发现数量较少的细胞亚群(比如仅占0.7%的小胶质细胞)以及表达量相对较低基因的功能模块,进而发现这种功能模块表达模式也具有区域和细胞亚型特异性,比如在丘脑相关的星形胶质细胞富集了音猬信号通路相关基因模块。
 图3:AD的亚型特异性神经元脆弱性
图3:AD的亚型特异性神经元脆弱性
对不同脑区细胞亚型进行鉴定和特征表达基因研究后,研究者进一步开始分析AD相关的细胞变化,发现AD导致兴奋性神经元、抑制性神经元和少突胶质细胞前体细胞数量有所下降,而少突胶质细胞和血管细胞数量有所上升,这些变化主要发生在EC、HC和PFC,尤其是晚期AD。针对不同区域特异的神经元亚型,多种亚型在AD患者中显著降低。这些AD易损神经元亚型的减少与AD病理以及认知功能下降显著相关,并且在AD患者中表现出不同脑区协同性降低的现象。这些易损神经元在转录层面存在一定的共性,比如Reelin通路相关的基因RELN和/或DAB1表达较高。RELN通常表达在抑制性神经元中,但也在两种EC易损兴奋性神经元中表达,而DAB1的表达在易损兴奋性神经元中有比较普遍的表达。
值得注意的是RELN和DAB1在易损抑制性神经元中表达也较高,这就提示Reelin通路在AD神经元损伤中有普遍且重要的作用。之后,研究人员利用阿尔兹海默病小鼠模型验证了Reelin(RELN)阳性兴奋性神经元的易损性。
此外,研究者还分析了病理性AD个体的细胞表达和功能的区域差异,发现所有区域星形胶质细胞、抑制性和兴奋性神经元的差异表达基因数量最高,而差异最大的脑区为EC。
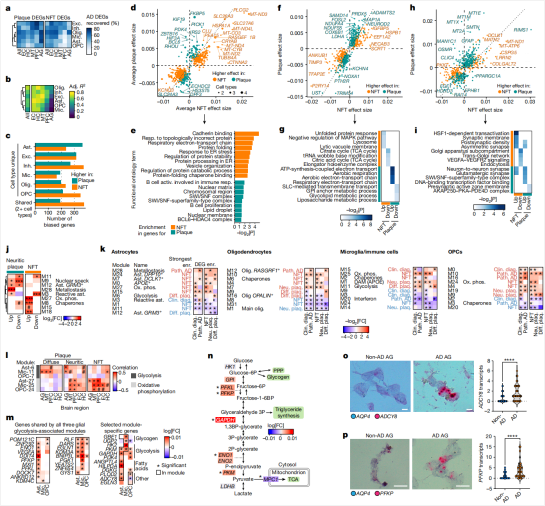
图4:基因表达模块注释和分离AD变化的病理变化
神经纤维缠结和淀粉样斑块负荷是AD最重要的病理特征。研究者进一步的分析了神经纤维缠结和淀粉样斑块负荷对不同脑区各类细胞类型的转录影响是否存在差异,发现神经纤维缠结和淀粉样斑块相关的差异基因存在较高的重叠(图4a),并且这种一致性在EC和HC最高(图4b)。
二者的差异体现在:神经纤维缠结主要影响蛋白质加工、电子传递等细胞基本功能,而淀粉样斑块则更多影响免疫、代谢调控等功能(图4d和e)。研究人员还进一步提取了神经元和各类胶质细胞的AD病理相关差异表达基因(图4c、4f-m),其中伴侣分子、糖酵解和氧化磷酸化相关差异表达基因在多种细胞类型中富集,但对于不同的AD病理或者细胞亚型,具体的差异表达基因会有不同(图4l-n),其中胶质细胞,特别是星形胶质细胞糖酵解发生了上调,并且这种变化是随着AD进展逐渐在不同脑区出现的。
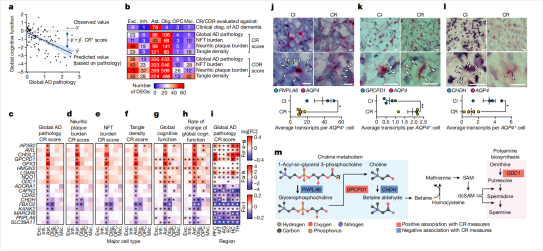
图5:CR与AD病理的分子相关性
由于AD患者认知能力变化不严格与AD病理的严重程度相关,因此研究人员进一步研究了与认知适应力(CR)相关的各类细胞转录变化,以期发现可能的分子机制。在前额叶皮层细胞中,星形胶质细胞是唯一一种在所有CR和认知衰退适应力(CDR)指标上都具有大量相关基因的细胞类型。在星形胶质细胞中,与CR相关的一些基因具有抗氧化活性,且其表达水平与认知功能正相关。还有一部分CR相关的基因与胆碱和多胺代谢有关,这些与CR相关的基因不仅在前额叶,在大脑其他区域的星形胶质细胞中也存在关联,这也为发开新型胆碱能/多胺系统靶向的抗AD药物提供了新的支持。
通过这篇研究,对AD进展中不同脑区不同细胞类型发生的变化有了更为全局和深入的认识,也验证了Reelin通路、糖代谢、胆碱能/多胺系统等作为AD新药开发靶点的潜力。
单细胞RNA测序技术在其他科研领域的应用。
● 1. 癌症生物学
单细胞RNA测序技术已经在肿瘤微环境的研究中发挥了重要作用。通过解析肿瘤内不同细胞类型及其相互作用,科学家可以更好地理解癌细胞如何逃避免疫监视、促进血管生成以及转移扩散。例如,一项针对乳腺癌的研究揭示了肿瘤相关巨噬细胞的不同亚群,并指出它们在支持肿瘤生长方面的独特功能。这样的发现有助于开发靶向特定细胞群体的免疫疗法。
● 2. 发育生物学
在胚胎发育过程中,不同组织器官的形成涉及复杂而有序的细胞分化过程。snRNA-seq能够追踪这一过程中的基因表达变化,帮助我们了解关键调控因子的作用机制。例如,有研究利用该技术绘制了小鼠心脏发育期间的心肌细胞图谱,展示了心肌祖细胞如何逐步成熟为功能性心肌细胞的过程。
● 3. 免疫学
免疫系统由多种多样的细胞类型构成,每种细胞都有其独特的功能。snRNA-seq使得研究者能够在单细胞水平上解析免疫应答的动态变化,这对于疫苗开发、过敏反应机制的理解以及自身免疫性疾病的研究至关重要。比如,一项关于流感病毒感染的研究通过snRNA-seq揭示了感染后肺部免疫细胞的变化情况,为理解宿主-病毒互作提供了新视角。
● 4. 神经系统疾病
除了阿尔茨海默病外,snRNA-seq也被广泛应用于帕金森病、亨廷顿舞蹈症等多种神经系统疾病的探究之中。这种技术可以帮助识别疾病特异性细胞亚型,从而为寻找新的治疗靶点提供线索。例如,有研究表明帕金森病患者的黑质多巴胺能神经元存在异常的基因表达模式,这些信息对于开发针对性药物具有重要意义。
● 5. 再生医学
scRNA-seq同样适用于干细胞和再生医学领域。通过监测干细胞分化过程中基因表达的变化,研究者可以更准确地控制细胞命运决定,进而推动组织工程和器官修复技术的发展。最近的研究表明,snRNA-seq有助于揭示诱导多能干细胞(iPSCs)重编程过程中关键转录因子的作用机制,这对于实现精准医疗有着深远的影响。
对于临床医生而言,这项研究所提供的详细细胞图谱有助于更好地诊断和监测AD的进展。例如,通过对血液或其他容易获取的生物样本进行类似的snRNA-seq分析,未来或许能够开发出非侵入性的生物标志物检测方法。此外,识别那些表现出较强认知韧性(CR)的细胞类型也为设计保护性策略提供了线索。长远来看,随着snRNA-seq技术成本的降低和技术成熟度的提升,它有望成为常规临床实践中不可或缺的一部分,助力于实现精准医疗的目标。
总之,借助单细胞RNA测序技术,本研究成功地绘制了一幅详尽的大脑细胞景观图,这不仅加深了我们对阿尔茨海默病的认识,也展示了这种先进技术在未来科学研究及临床实践中的广阔前景。
注:本文旨在介绍医学研究进展,不做治疗方案推荐。如有需要,请咨询专业临床医生。
参考文献:
Mathys H, Boix CA, Akay LA, Xia Z, Davila-Velderrain J, Ng AP, Jiang X, Abdelhady G, Galani K, Mantero J, Band N, James BT, Babu S, Galiana-Melendez F, Louderback K, Prokopenko D, Tanzi RE, Bennett DA, Tsai LH, Kellis M. Single-cell multiregion dissection of Alzheimer's disease. Nature. 2024 Aug;632(8026):858-868.
